
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема 19. Ізопреноїди.
Терпени і терпеноїди. Класифікація терпенів за кількістю ізопренових фрагментів та природою карбонового скелету. Природні джерела. Ациклічні терпени: гераніол, цитраль. Моноциклічні монотерпени: лимонен, ментан, ментол, терпін, терпінгідрат. Хімічні властивості. Біциклічні терпени: α-пінен, борнеол, камфора, бромкамфора.
Основным биогенетическим предшественником всех изопреноидов является изопрен (2-метилбутадиен-1,3) — разветвленный ненасыщенный углеводород из пяти углеродных атомов. В организмах животных и в растениях активный изопрен, 5-изопентенилдифосфат, служит исходным соединением для биосинтеза линейных и циклических олигомеров и полимеров.

где n - число изопреновых фрагментов, которых обычно бывает 2 – 8.
А. Ацетил-КоА как предшественник липидов
Различные группы липидов, присутствующие в животных и растительных тканях тесно связаны биогенетически: все они произошли от одного предшественника — ацетилкофермента А [ацетил-КоА (ацетилCoA)], представляющего собой активированную форму уксусной кислоты.
1. От ацетил-КоА основной путь биосинтеза ведет к активированным жирным кислотам, из которых затем синтезируются жиры, фосфолипиды, гликолипиды и другие производные жирных кислот. В количественном отношении этот путь является главным в животных и в большинстве растительных тканей.
2. Второй путь биосинтеза ведет от ацетил-КоА к 3-изопентенилдифосфату («активному изопрену»), главному структурному элементу изопреноидов. Биосинтез этого соединения обсуждается в связи с биогенезом холестерина.
Б. Изопреноиды и терпены
Терпены – это группа липидов или жироподобных веществ природного происхождения, которая включает в себя терпеновые углеводороды и их кислородсодержащие производные (спирты, альдегиды, кетоны), называемые терпеноидами. Терпеновые углеводороды построены из фрагментов изопрена.
Связывание молекул изопрена происходит по принципу «голова к хвосту» (изопреновое правило, сформулированное в 1921 году Л. Ружичкой), которое позволило выяснить строение многих терпенов и родственных им соединений.

Натуральный каучук также можно считать терпеном. Однако изопрен, который является родоначальником класса терпенов (n = 1), не принято относить к терпенам.
Классификация терпенов.
1. По количеству изопреновых звеньев терпены подразделяют на следующие ряды:
— монотерпены, или собственно терпены (n = 2; соед., содержащие 2 изопреновых фрагмента);
— сесквитерпены (n = 3, название произошло от сескви — полтора);
— дитерпены (n = 4); — тритерпены (n = 6); — тетратерпены (n = 8); — политерпены (n > 8).
2. По наличию или отсутствию циклов, по количеству имеющихся циклов каждый из вышеприведенных рядов подразделяется на следующие группы:

Природные источники терпенов. В природе терпены встречаются в растениях и входят в состав эфирных масел. Кроме терпенов в эфирных маслах находятся вещества самой разнообразной структуры: спирты, альдегиды, сложные эфиры и др.
По консистенции эфирные масла походят на масла, хотя по химическому строению таковыми не являются. В отличие от жирных масел, эфирные масла — летучие жидкости. Они полностью испаряются, не оставляя жирных пятен. Свое название эфирные масла получили благодаря их летучести и свойству обладать приятным запахом.
АЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
В основе углеродного скелета ациклических терпенов лежат структуры изомерных димеров изопрена — оцимена и мирцена:




При написании терпеноидов широко применяются общепринятые формулы, в которых показан только углеродный скелет без отражения алкильных заместителей.
Мирцен содержится в эфирном масле лавра благородного и хмеля обыкновенного, а оцимен — в эфирном масле базилика обыкновенного, васильков и др.
 Производные этих монотерпенов — гераниол и нерол — содержатся в эфирном масле розы и герани и являются геометрическими изомерами. При их окислении получают альдегиды — цитраль А и цитраль В — природные компоненты лимонного масла. В кислой среде нерол легко циклизуется в α-терпинеол:
Производные этих монотерпенов — гераниол и нерол — содержатся в эфирном масле розы и герани и являются геометрическими изомерами. При их окислении получают альдегиды — цитраль А и цитраль В — природные компоненты лимонного масла. В кислой среде нерол легко циклизуется в α-терпинеол:
Смесь цис- и транс-изомеров цитраля — желтая маслянистая жидкость с антисептическим, болеутоляющим, противовоспалительным действиями, используется в офтальмологии; наряду с гераниолом и неролом применяется как отдушка в парфюмерно-косметической промышленности. Цитраль отпугивает некоторые виды муравьев, используется как репеллент.
МОНОЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
МЕНТАН и ЛИМОНЕН
Лимонен и ментан — наиболее важные представители моноциклических терпенов.
Ментан — родоначальник группы моноциклических терпеноидов, в природе в свободном виде не встречается. Он может быть получен гидрированием лимонена или п-цимола. Ментан — жидкость со свойствами предельных циклических углеводородов.
Лимонен — жидкость, обладающая свойствами непредельных углеводородов. (-)-Лимонен и его рацемат входят в состав скипидара, эфирных масел хвойных деревьев, (+)-лимонен — в эфирное масло цитрусовых (до 90%), бергамота, тмина, сельдерея. Лимонен обусловливает запах лимонного масла, из которого и был впервые получен.
Лимонен имеет один асимметрический атом углерода и существует в виде двух зеркальных изомеров. Рацемическую форму — (±)-лимонен (дипентен) — получают изомеризацией изопрена или при сухой перегонке каучука. При 500—700 °С происходит обратный процесс — крекинг дипентена.
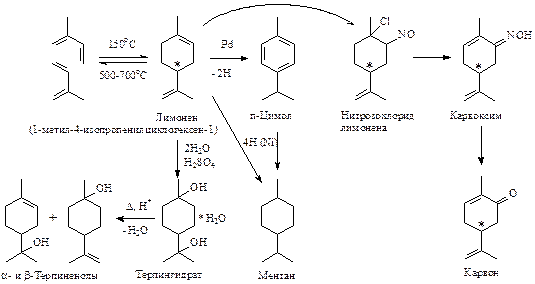
При нагревании терпина в присутствии кислоты образуются изомерные α- и β-терпинеолы (ментен-1-ол-8 и ментен-8-ол-1).
Ментадиол — двухатомный спирт, его моногидрат под названием терпингидрат проявляет антисептическое, слабое мочегонное действие, используется как отхаркивающее средство.
В парфюмерно-косметической промышленности используются α-терпинеол с запахом сирени и β-терпинеол с запахом ландыша.
Из лимонена или дипентена через нитрозохлорид и карвоксим может быть получен карвон (2-метил-5-(1-метиленэтенил)-2-циклогексенон), S(+)-карвон определяет запах семян тмина и укропа, а его зеркальный изомер, R(-)-карвон, пахнет колосовой (остролистой) мятой.
МЕНТОЛ
Из кислородсодержащих производных ментана большое значение имеет ментол (п-ментанол-3) — основной компонент эфирного масла мяты перечной. Соединение имеет три асимметрических центра и может существовать в виде восьми оптических изомеров. Наибольшее значение из изомеров имеет (-)-ментол, у которого гидроксильная, метильная и изопропильная группы размещены экваториально. Такой изомер обладает специфическим запахом, антисептическим действием и вызывает характерное чувство холода при действии на кожу.
Ментол можно получить вымораживанием мятного масла или восстановлением (-)-ментона, содержащегося до 20% в эфирном масле мяты:

(±)-Ментол в промышленности получают алкилированием п -крезола по реакции Фриделя—Крафтса с последующим каталитическим гидрированием образующегося тимола.
Химические свойства. Ментол — вторичный циклический спирт, при взаимодействии с изовалериановой кислотой образует сложный эфир:

Ментол — твердое кристаллическое вещество с запахом мяты, используется как слабое антисептическое, успокаивающее, обезболивающее средство в составе лекарственных веществ (бороментол, пектусин и др.), 30%-ный раствор ментола в ментилизовалерате под названием валидол используют при стенокардии. Ментол применяют в кондитерской и парфюмерно-косметической промышленности.
БИЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
Чаще всего в основе строения терпеноидов этой группы лежат четыре структуры:

1) 2,6,6-триметилбицикло[3.3.1]гептан, 2) 1,7,7-триметилбицикло[2.2.1]гептан, 3) 4,7,7-триметилбицикло[4.1.0]гептан, 4) 1-изопропил-4-метилбицикло[3.1.0]гексан, 5) 2,6,6-триметилбицикло[3.1.1]гепт-2-ен.
Производные туйана (туйон) и карана (карены) содержатся в эфирном масле шалфея.
α-Пинен — ненасыщенное производное пинана — наиболее распространенный в природе представитель этой группы.
α-ПИНЕН
α-Пинен находится в различных эфирных маслах, но основная масса — до 75% в скипидаре (терпентинном масле). Молекула α-пинена содержит два асимметрических центра и обладает оптической активностью. Левовращающий α-пинен преобладает в сосне приморской (лат. Pinus pinaster), а правовращающий — в сосне лесной (Pinus sylvestris).
Химические свойства. α-Пинен — типичное непредельное соединение с присущими этому классу свойствами.
1. Взаимодействие с разбавленными кислотами. При нагревании с разбавленными кислотами (азотной, серной) α-пинен превращается в α-терпинеол и терпин.

2. Окисление. Пинен и скипидар окисляются кислородом, превращаясь в α-пероксид.

Полученный α-пероксид можно обнаружить по окислительным свойствам. Если к крахмалу добавить КI, а затем скипидар, то при взбалтывании образовавшийся пероксид α-пинена вытесняет I2 из КI и окрашивает крахмал в синий цвет. Воздух вокруг хвойных деревьев озонирован. Это связано с тем, что в составе их эфирных масел в большом количестве содержится образующий пероксиды α-пинен. Пероксиды разлагаются с образованием атомарного кислорода, который, соединяясь с кислородом воздуха, образует озон.
3. Взаимодействие с хлороводородом. α-Пинен с НС1 образует борнилхлорид — твердое вещество с запахом камфоры, которое используется для синтеза камфоры:

4. Взаимодействие с органическими кислотами. Органические кислоты, присоединяясь к α-пинену, с небольшим выходом дают сложные эфиры борнеола. α-Пинен и скипидар используют как растворители, ускорители затвердевания (высыхания) красок за счет пероксидов. Скипидар применяют в медицине как местнораздражающее, обезболивающее и антисептическое средство.
α-Пинен и борнеол используют для синтеза камфоры (1,7,7-триметилбицикло-[2,2,1]-гептан-2-он).

БОРНЕОЛ (борниловый спирт, камфанол-2) это спирт камфанового ряда, имеющий за счет трех асимметрических атомов углерода оптические изомеры: энантиомеры, диастереомеры борнеола и изоборнеола. Борнеол получил название от борнейского лавра, из эфирного масла которого он был впервые получен на острове Борнео.
Это кристаллическое вещество с температурой плавления 204—208,5 °С, температурой кипения 212 °С, растворим в спирте и нерастворим в воде.
Химические свойства. Борнеол обладает свойствами вторичных спиртов, вступает в реакции окисления с образованием кетона — камфоры, в реакции замещения ОН-группы на галоген образует сложные эфиры с органическими кислотами.

При кипячении с металлическим натрием в ксилоле происходит взаимное превращение друг в друга изоборнеола и борнеола. Борнеол и его эфиры используют как душистые вещества в мыловарении, парфюмерной, кондитерской промышленности. Они понижают кровяное давление.
Камфора (камфара, 2-борнанон, 1,7,7-триметилбицикло[2.2.1]гептан-2-он) является бициклическим кетоном на основе камфана (борнана). В структуре молекулы содержатся два асимметрических атома углерода, но вместо четырех ожидаемых изомеров камфора существует только в виде двух энантомеров. отсутствие диастереомеров объясняется тем, что асимметрические атомы жестко связаны между собой тремя углеродными цепями, это исключает возможность иной конфигурации.
1. Получение из природных источников. Камфору получают из 80-100-летних деревьев камфорного дерева, которое произрастает во Вьетнаме, Китае, Японии, на Тайване, а также культивируется в тропиках. Камфора содержится в эфирных маслах камфорного лавра, сибирской пихты, базилика, полыни, камфорного шалфея. Природные источники не удовлетворяют потребности в камфоре, поэтому используются полусинтетические и синтетические способы получения.
2. Получение из борнилацетата (метод Н. В. Вершинина). Этот метод получения камфоры из пихтового масла, содержащего 30 — 40% борнилацетата, имеет промышленное значение. Борнилацетат отделяют, подвергают омылению и полученный (-)-борнеол окисляют хромовой смесью в (-)-камфору.
3. Получение рацемической камфоры из α-пинена (синтез В. Е. Тищенко):

Камфора — бесцветное кристаллическое вещество (т. пл — 178 оС) с резким характерным запахом, флуоресцирует в УФ-свете, растворима в спирте, малорастворима в воде. Вращение и хаотическое движение кристаллов по поверхности воды связаны с тем, что камфора летуча (легко сублимируется). Упругость ее паров на разных поверхностях кристалла неодинакова, вследствие этого кристалл с разными гранями с различной силой отталкивается от поверхности пленки воды, что и вызывает его вращение.
Химические свойства. Камфора — типичный кетон. С участием оксогруппы она образует оксимы, семикарбазоны, фенилгидразоны.
1. Взаимодействие с гидроксиламина гидрохлоридом:
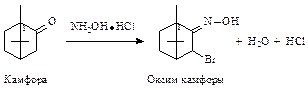
Реакция применяется для количественного определения камфоры по выделяемому эквивалентному количеству НС1.
2. Окисление и восстановление камфоры:

3. Взаимодействие с бромом. Карбонильная группа активирует атомы водорода в α-положении, метиленовая группа проявляет СН-кислотный характер, в результате чего возможно замещение на галоген:

В медицине камфору используют как кардиотоническое, аналептическое, местнораздражающее и антисептическое средство, в промышленности как пластификатор, компонент бездымного пороха, репеллент. Бромкамфору применяют при заболеваниях центральной нервной системы как успокаивающее средство.


ТЕРПЕНЫ, группа преим. ненасыщ. углеводородов состава (C5H8)n, где n≥2; широко распространены в природе (гл. обр. в растит., реже в животных организмах). Все терпены обычно рассматривают как продукты полимеризации изопрена (см. Изопреноиды), хотя биосинтез их иной: протекает аналогично биосинтезу карбоновых к-т, т.е. через ацетилкоэнзим А и ацетоацетилкоэнзим А. Дальнейшие биохим. превращения приводят к образованию мевалоновой к-ты, к-рая в результате ферментативного фосфорилирования, декарбоксилирования и дегидратаций переходит в изопентенилпирофосфат, изомеризующийся затем в диметилаллилпирофосфат. Два последних, взаимодействуя друг с другом, образуют геранилпирофосфат, который далее алкилирует изопентенилпирофосфат до фарнезилпирофосфата; эти С10 и С15 соединения являются ключевыми при биосинтезе всех терпенов.
По числу изопреновых звеньев терпены подразделяют на: монотерпены, или собственно терпены С10Н16 (часто только эти в-ва подразумевают под терпенами, напр. лимонен, мирцен); сесквитерпены, или полуторатерпены С15H24 (напр., бизаболен); дитерпены и их производные С20Н32 (напр., смоляные кислоты - абиетиновая, левопимаровая и др.); тритерпены С30Н48 (напр., некторые гормоны и стерины - ланостерин, олеаноловая к-та, сквален и т. д.); политерпены (Каучук натуральный).
Каждый ряд терпенов разделяется на группы:
1) алифатические, или ациклические, - соединения с открытой цепью углеродных атомов; монотерпены этой группы включают три двойные связи (напр., аллооцимен, оцимен).
2) Карбоциклические - содержат одно или неск. колец углеродных атомов. По числу колец различают: а) моноциклические, собственно терпены данной группы включают две двойные связи (ментадиены, в т. ч. терпинены, терпинолен и др.); б) бициклические, монотерпены этой группы содержат только одну двойную связь (см. Камфен, Карены, Пинены); в) трициклические, монотерпены данной группы не содержат двойных связей (напр., трициклен); г) сесквитерпены, дитерпены, тритерпены и политерпены могут содержать и более трех циклов.
Сопутствующие обычно терпенам их производные часто наз. терпеноидами, по характеру функц. групп они разделяются на спирты, альдегиды, кетоны, сложные эфиры, пероксиды, к-ты и т.д. [напр., борнеол, камфора, (-)-ментол, терпинеолы].
Монотерпены и сесквитерпены часто обладают довольно приятным запахом. Особенно нежный запах характерен для их кислородных производных (спирты, альдегиды, сложные эфиры); именно они вместе с терпенами обусловливают аромат цветов, запах хвойных и многих иных растений.
Терпены имеют, как правило, плотн. менее 1 г/см3; т.кип. собственно терпенов 150-190°С, сесквитерпенов 230-300 °С, дитерпенов более 300 °С; т. кип. терпеноидов обычно выше, чем т. кип. соответствующих терпенов. Все терпены раств. в орг. р-рителях (в первую очередь в неполярных), не раств. в воде, хорошо растворяют масла, жиры и смолы. Многие терпены перегоняются (обычно в вакууме) с водяным паром: монотерпены легче, сесквитерпены и дитерпены труднее. Природные терпены в осн. оптически активны.
Терпены весьма реакционноспособны: легко окисляются на воздухе, особенно на свету, часто превращаясь при этом в кислородсодержащие соед.; при нагр. изомеризуются (прежде всего при взаимодействии с кислыми агентами); диспропорционируют в присутвии катализаторов (Pd, Pt, Ni); по двойным связям легко гидрируются, гидратируются, присоединяют галогены, галогеноводороды, орг. к-ты и т. д. При сильном нагревании без доступа воздуха (400-500 °С) кольца терпенов раскрываются, причем из бициклических терпенов можно получить моноциклические и даже алифатические (см. Камфеновые перегруппировки). При нагр. до 700 °С и выше все терпены разлагаются с образованием сложной смеси продуктов (изопрен, ароматич. углеводороды и др.).
Терпены выделяют из прир. сырья (живица, эфирные масла, скипидар, бальзамы и т. д.) перегонкой с водяным паром, экстракцией летучими растворителями, а также путем анфлеража (извлечение нелетучими растворителями - жирами, маслами); индивидуальные терпены из их смесей получают фракционной перегонкой в вакууме, методами хроматографии, вымораживанием и др. Многие терпены и их производные получают также синтетически (напр., камфору).
Терпены и терпеноиды широко применяют (индивидуально или в виде скипидара, смол, эфирных масел, бальзамов и т.п.) в производствах парфюмерных композиций, косметических изделий, бумаги и картона; как пищ. эссенции, лек. ср-ва, р-рители, пластификаторы, инсектициды, иммерсионные жидкости, флотореагенты и др.
Литература: Никитин В.М., Химия терпенов и смоляных кислот, М.-Л., 1952; Каррер П., Курс органической химии, пер. с нем., 2 изд., Л., 1962, с. 836-54; Овчинников Ю. А., Биоорганическая химия, М., 1987, с. 693-702; Kirk-Othmer encyclopedia, 3 ed., v. 22, N. Y., 1983, r. 709- 62. См. также лит. при статьях Сесквитерпены, Скипидар, Терпеновые смолы, Терпеновые спирты и др.
| <== предыдущая лекция | | | следующая лекция ==> |
| Номенклатура гетероциклических соединений. | | | ЛЕКЦИЯ 65. Февральская революция 1917 г. Падение самодержавия. |
Не нашли, что искали? Воспользуйтесь поиском: