
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
СВОЙСТВА РАСТВОРОВ ВМС
Истинные растворы ВМС по своим свойствам резко отличаются от растворов низкомолекулярных соединений:
1) Осмотическое давление растворов ВМС не подчиняется закону Вант-Гоффа.
Обычно экспериментально определенное значение осмотического давления растворов ВМС значительно выше значения, рассчитанного по уравнению Вант-Гоффа. Объясняется это тем, что макромолекула благодаря своей гибкости ведет себя в растворе как несколько более коротких молекул. При повышении концентрации возрастает число сегментов макромолекулы, которые ведут себя независимо друг от друга. Для вычисления осмотического давления π растворов ВМС предложено следующее уравнение:

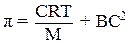 ,
,
где С – массовая концентрация раствора;
М – молярная масса полимера;
Т – абсолютная температура;
где B – константа, зависящая от природы растворителя.
2) Скорость диффузии макромолекул полимера невелика, она сопоставима со скоростью диффузии типичных коллоидных частиц.
Для расчета коэффициента диффузии ВМС применимо уравнение Эйнштейна:
 =
=  ;
;
где В – коэффициент трения диффундирующих частиц данной формы.
Для сферических частиц В = 6πηr. Однако макромолекулы ВМС редко имеют форму, близкую к сферической.
3) Растворы ВМС способны рассеивать свет, хотя и в меньшей степени, чем типичные коллоидные системы. В растворах ВМС эффект Тиндаля обнаруживается не совсем четко вследствие того, что показатель преломления сольватированных частиц растворенного вещества n мало отличается от показателя преломления растворителя n0, поэтому разность (n – n0) > 0, но интенсивность рассеяния света растворами ВМС незначительна. По этой же причине макромолекулы невозможно обнаружить под ультрамикроскопом. Кроме того, макромолекулы соизмеримы с коллоидными частицами только по длине, а в других направлениях соответствуют размерам обычных молекул
4) Растворы ВМС обладают высокой вязкостью. Только очень разбавленные растворы подчиняются законам Ньютона и Пуазейля (см. «Вязкость ВМС»).
5) Растворы ВМС являются истинными растворами, агрегативно устойчивыми системами. Однако при добавлении электролитов наблюдается выделение высокомолекулярных соединений из раствора. Это явление называется высаливанием (см. «Устойчивость растворов ВМС»).
6) Для растворов ВМС характерно явление коацервации. Коацервация – это разделение системы на две фазы, из которых одна представляет собой раствор ВМС в растворителе, а другая – раствор растворителя в ВМС, при изменении температуры или рН или при введении низкомолекулярных веществ (см. «Устойчивость растворов ВМС»).
7) Для растворов ВМС характерно явление спонтанного, самопроизвольного изменения вязкости при длительном хранении растворов. Это явление носит название старение раствора. Старение происходит либо в результате деструкции макромолекул полимера, либо в результате связывания макромолекул. Старение происходит под влиянием кислорода и некоторых других примесей.
8) При увеличении концентрации растворов ВМС, изменения температуры или при добавлении электролита возможно образование пространственной сетки, приводящей к образованию студня (см. «Устойчивость растворов ВМС»).
ВЯЗКОСТЬ ВМС
Основными факторами, определяющими структуру и реологические свойства дисперсной системы, является концентрация частиц дисперсной фазы и энергия взаимодействия частиц. В разбавленных агрегативно устойчивых дисперсных системах частицы сохраняют полную свободу взаимного перемещения, или, как говорят, определенная структура отсутствует. Такие системы относятся к ньютоновским.
Их вязкость описывается законом Эйнштейна: вязкость дисперсной системы (золя, суспензии) увеличивается с ростом содержания дисперсной фазы.
Эта связь выражается уравнением:
(η − η0) / η0 = k·φ, (*)
где η и η0 − вязкости коллоидного раствора и дисперсионной среды соответственно;
φ = Vd/V − объемная доля дисперсной фазы (Vd) в общем объеме системы (V);
k − константа, зависящая от формы частиц.
Физический смысл этого закона заключается в том, что относительное приращение вязкости прямо пропорционально относительному содержанию в системе дисперсной фазы. Чем больше объемная доля дисперсной фазы в системе, тем сильнее выражено тормозящее влияние части на поток жидкости (прямая I на рис.5).

Рис.5 – Зависимость вязкости от объемной доли дисперсной фазы для:
I – бесструктурной (ньютоновcкой) дисперсной системы; II – структурированной (неньютоновской) дисперсной системы.
Структурированные коллоидные системы не подчиняются закону Эйнштейна. Для них значение вязкости увеличивается с ростом содержания дисперсной фазы значительно сильнее, чем следует из уравнения Эйнштейна (кривая II на рис.5).
Согласно современным представлениям, достаточно гибкие молекулы ВМС в растворе находятся в виде статистических клубков, пропитанных растворителем. Наличие таких клубков, а также образование структур в растворе обусловливает аномальную зависимость вязкости растворов полимеров от их концентрации, не подчиняющуюся уравнению Эйнштейна. Растворы ВМС – неньтоновские жидкости.
Зависимость удельной вязкости не слишком концентрированных растворов полимеров от концентрации обычно удовлетворительно описывается уравнением, предложенным Хаггинсом:
 = [η] + k1[η]2С,
= [η] + k1[η]2С,
η уд = (η − η0) / η0 − удельная вязкость (см. табл.1);
где [η] − характеристическая вязкость (см. табл.1);
С − концентрация раствора, г/100 мл;
k1 − коэффициент, называемый константой Хаггинса.
Коэффициент k1 служит характеристикой взаимодействия макромолекул в системе полимер − растворитель. Его значение практически не зависит от молярной массы полимера и меняется лишь в зависимости от природы растворителя. Во взаимодействующих с ВМС растворителях, значение константы Хаггинса составляет 0,2 − 0,3.
Таблица 1 − Обозначения и названия величин, принятые в вискозиметрии растворов полимеров
| Обозначение величины | Название |
| η отн = η/η0 | Относительная вязкость |
| η уд = (η − η0)/η0 = η отн − 1 | Удельная вязкость |
| η пр = η уд/ С | Приведенная вязкость |
| ln η отн / С | Логарифмическая приведенная вязкость |
| [η] = (η уд/ С) С→0 == (ln η отн / С) С→0 | Характеристическая вязкость |
Характеристическая вязкость, отражающая гидродинамическое сопротивление молекул полимера потоку жидкости, может быть определена для разбавленных растворов полимеров, в которых взаимодействием макромолекул можно пренебречь. Для нахождения характеристической вязкости устанавливают зависимость приведенной вязкости от концентрации в узком интервале малых концентраций и полученные результаты экстраполируют к нулевой концентрации (рис.6).

Рис. 6 − График для определения характеристической вязкости раствора ВМС
Связь между характеристической вязкостью раствора ВМС и молярной массой полимера удовлетворительно описывается эмпирическим уравнением Марка –Хаувинка:
[η] = К·Мα,
где α – постоянная (как и «К») для данного полимергомологического ряда в конкретном растворителе при определенной температуре. Постоянная «α» отражает степень свертывания молекул полимера и гибкость цепи. Для жестких палочкообразных молекул α ≈ 1, для гибких молекул, свернутых в глобулу α ≈ 0,5.
Зная характеристическую вязкость раствора ВМС, по уравнению Марка –Хаувинка можно определить молярную массу полимера:
Мα = [η]/ К или lgM =  .
.
Следует отметить, что полученное значение молярной массы является среднестатистическим, поскольку любой реальный полимер представляет собой полидисперсную смесь макромолекул.
Не нашли, что искали? Воспользуйтесь поиском: