
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Физико-механические свойства твердых тел.
Лекция 22. ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ.
КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА. ТИПЫ СВЯЗЕЙ
В КРИСТАЛЛАХ
Физико-механические свойства твердых тел.
Кристаллические и аморфные тела
Если средняя кинетическая энергия движения молекул становится по величине меньше потенциальной энергии их взаимодействия, то вещество переходит в твердое состояние (кристаллическое или аморфное).
 Для пространственного описания внутренней структуры кристаллических тел пользуются понятием кристаллическая решетка. Кристаллическая решетка — пространственное расположение частиц (узлов решетки) вещества друг относительно друга. Для нее характерна определенная периодичность, которую обычно различают как периодичность ближнего (между непосредственно соседствующими узлами), так и дальнего (для отдельных кристаллов и всего твердого тела в целом) порядка.
Для пространственного описания внутренней структуры кристаллических тел пользуются понятием кристаллическая решетка. Кристаллическая решетка — пространственное расположение частиц (узлов решетки) вещества друг относительно друга. Для нее характерна определенная периодичность, которую обычно различают как периодичность ближнего (между непосредственно соседствующими узлами), так и дальнего (для отдельных кристаллов и всего твердого тела в целом) порядка.
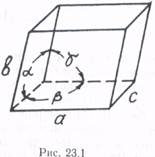
В основе кристаллической решетки лежит элементарная ячейка, представляющая собой параллелепипед (рис. 23.1) с характерным для данной решетки расположением узлов (в узлах могут находиться атомы, ионы, молекулы).
Большое число одинаковых элементарных кристаллических ячеек, плотно прилегающих друг к другу и сохраняющих параллельность ребер и граней, образует кристалл (дальний порядок).
Формы кристаллов чрезвычайно разнообразны, но число возможных элементарных ячеек, обладающих различной симметрией, ограниченно.
Если рассматривать только пространственную периодичность в расположении атомов (или ионов, молекул), можно отвлечься от физической структуры и рассматривать атомы как геометрические точки. Такое представление о пространственной решетке было введено Огюстом Браве. Пространственные решетки получили название решеток Браве, а ячейки, которые их образуют, называются ячейками Браве.
Итак, решетка Браве — бесконечная периодическая структура, образованная дискретными точками и имеющая абсолютно одинаковый пространственный порядок и ориентацию (причем, пространственный порядок и ориентация не зависят от того, какую точку структуры мы принимаем за исходную).
По форме ячейки в зависимости от базисов а, b, с и углов α, β, γ (рис. 23.1) подразделяются на 14 типов решеток — решеток Браве (О. Браве на основе чисто геометрических рассуждений рассчитал число возможных типов решеток). Е. С. Федоров исходя из предположения, что плотное заполнение пространства кристаллическими ячейками возможно только при определенной форме ячеек, определил количество возможных типов геометрического расположения атомов в кристаллах. Оказалось, что может существовать 230 пространственных групп решеток с различными типами симметрии. Всe эти типы решеток встречаются в природе.
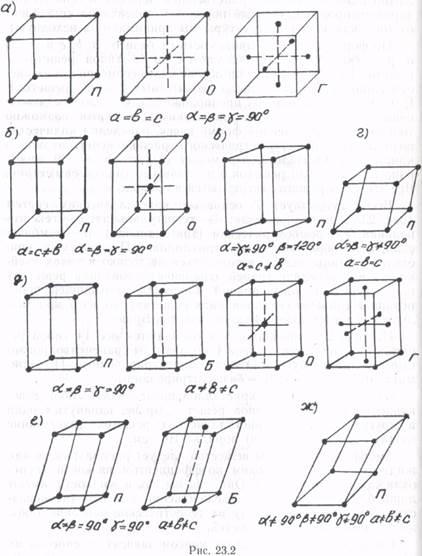
Всего существует 7 основных кристаллических систем (рис. 23.2): а — кубическая; б — тетрагональная; в — гексогональная; г — ромбоэдрическая (тригональная); д — ромбическая; е — моноклинная; ж — триклинная. Поскольку в кристалле частицы могут располагаться не только в узлах ячейки, но и в середине граней (гранецентрированная решетка) или в середине диагональной плоскости, проходящей через вершины (объемоцентрированная решетка), то все 7 кристаллических систем дают 14 типов решеток Браве.
На рис. 23.2 показано, чем отличаются все 14 типов решеток друг от друга: буквой Г обозначены гранецентрированные кристаллы; буквой О — объемоцентрированные; П — примитивные (простые); Б — базоцентрированные.
Значительная часть кристаллов представляет собой совокупность нескольких типов решеток Браве, вдвинутых одна в другую, периоды кристаллических решеток (расстояние между соседними узлами) порядка 10 -7 см.
Аморфные структуры вещества следует рассматривать как жидкости с очень высоким коэффициентом вязкости (переохлажденные жидкости). Они, так же как и жидкости, имеют лишь ближний порядок в расположении молекул (непосредственных соседей), поэтому их теоретическое описание такое же сложное, как и у жидкостей.
Свойства аморфных тел во многом зависят от способа их образования. Иногда одно и то же вещество может при данной температуре существовать как в аморфном, так и в кристаллическом состоянии (стекло, сера, гипосульфит и т. д.). При низких температурах аморфное вещество способно медленно переходить в кристаллическую форму (стекло, сера, олово).
Поэтому, строго говоря, твердыми телами следует называть только кристаллические тела, а аморфные можно рассматривать как сильно переохлажденные жидкости с очень большим коэффициентом вязкости.
Различие между аморфными и кристаллическими телами удобно рассматривать с энергетической стороны: плавление и отвердевание кристаллических тел происходит при определенной температуре, при которой вещество одновременно может находиться в жидкой и твердой фазах; аморфные тела не имеют определенной температуры плавления. На рис. 23.3 изображены процессы плавления кристаллического и аморфного тел, по осям отложена температура Т и время t.
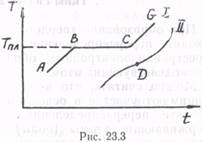 На участке АВ (кривая I) происходит нагревание кристаллического тела, на участке ВС твердое тело переходит в жидкое состояние при постоянной температуре T пл, подводимая теплота полностью расходуется на перевод из кристаллического состояния в жидкое (на разрушение дальнего порядка). Молекулы тела, получая энергию, приобретают большую свободу движения, могут двигаться поступательно. Таким образом, единица массы жидкости, находящейся при температуре плавления, обладает большей внутренней энергией, чем единица массы кристаллической фазы. Разность этих энергий равна удельной теплоте плавления. Молярная теплота кристаллизации у различных веществ меняется не очень сильно: от 102 до 104 Дж/моль. Участок CG соответствует нагреванию жидкой фазы.
На участке АВ (кривая I) происходит нагревание кристаллического тела, на участке ВС твердое тело переходит в жидкое состояние при постоянной температуре T пл, подводимая теплота полностью расходуется на перевод из кристаллического состояния в жидкое (на разрушение дальнего порядка). Молекулы тела, получая энергию, приобретают большую свободу движения, могут двигаться поступательно. Таким образом, единица массы жидкости, находящейся при температуре плавления, обладает большей внутренней энергией, чем единица массы кристаллической фазы. Разность этих энергий равна удельной теплоте плавления. Молярная теплота кристаллизации у различных веществ меняется не очень сильно: от 102 до 104 Дж/моль. Участок CG соответствует нагреванию жидкой фазы.
Кривая II (рис. 23.3) для аморфных тел не имеет горизонтального участка, имеется лишь точка перегиба D. Температура, соответствующая этой точке, условно называется температурой размягчения (плавления) аморфных тел. Как видно из графика, размягчение аморфных тел происходит весьма постепенно, удельная теплота плавления отсутствует. Подвод тепла приводит к плавному повышению температуры (увеличению энергии теплового движения молекул), уменьшению вязкости.
Таким образом, с энергетической точки зрения кристаллические и аморфные тела принципиально различаются тем, что процесс плавления кристаллических тел и обратный ему (кристаллизация) сопровождаются тепловым эффектом (поглощением или выделением тепла) при постоянной Т. При неизменной температуре у аморфных тел этот эффект не наблюдается.
Другое важное отличие кристаллических тел от аморфных — явление анизотропии, т. е. зависимости свойств (электропроводности, теплопроводности, двойного лучепреломления и т. д.) от выбранного направления в теле.
Не нашли, что искали? Воспользуйтесь поиском: