
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
1 страница. Эйнштейннің салыстырмалылық теориясыФарадейдің 1831 ж ашқан экспериментінің негізінде Максвелл электромагниттік толқындар
Эйнштейннің салыстырмалылық теориясыФарадейдің 1831 ж ашқан экспериментінің негізінде Максвелл электромагниттік толқындар теориясына сүйеніп, жарықтың табиғаты электромагниттік толқын деген ігікір айтты. Сендерге белгілі, Фарадей эксперимент аркылы электромагниттік индукция заңын ашқан. Максвелл гипотезасының мазмүны: өзгермелі магнит өрісі айнымалы қүйынды электр өрісін туғызады және керісінше. Гипотезаның дүрыстығы көптеген тәжірибелер арқылы дәлелденді.Эйнштейн бірінші болып механика мен электродинамика зандарын біріктірді және кеңістік пен уақытқа жаңа көзкарас берді. Арнайы салыстырмалылық теориясының екі постулаты негізінде ол Лоренц алған координаталарды, уақытты, денелердің сызьщтық өлшемдерін түрлендіру формулаларын қорытып алды. Галилей түрлендіруі



Галилей түрлендірулерінің нәтижелері.
1. Жылдамдықтардың релятивитстикалық болмаған қосу заңы
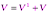
Галилей түрлендіруі бойынша келіп шыққан формула.
2. Денелердің дара әсерлесу күштері барлық инерциалдық санақ жүйелерде бірдей, яғни күш Галилей түрлендірулеріне салыстырғанда инвариант болады. 
3.Ньютон заңдары барлық инвариант санақ жүйелерде бірдей болады.
Қозғалыс үдеуі де Галилей түрлендіруіне салыстырғанда инвариант болады.Галилей түрлендірулері Ньютон заңдарына негізделінген, салыстырмалы теорияны классикалық салыстырмалы теория деп атайды.Релятивистикалық салыстырмалы теория Лоренц түрлендірулері және Энштейннің арнайы салыстырмалы теориясына негізделінеді.Лоренц түрлендірулері Галилей түрлендірулерімен сәйкес келмейді.
17. Лоренц түрлендірулері,— бір инерциялық санақ жүйесінен екіншісіне ауысқан кездегі қандай да бір оқиғаның координаттары мен уақытының түрленуі. Мұны бірінші рет голландиялық физигі Х. А. Лоренц (1853 — 1928) ашқан (1904). Лоренц түрлендірулеріне қарағанда классикалық микроскопты электродинамика теңдеуі өзінің түрін өзгертпейді. “Лоренц түрлендірулері” деген атауды Альберт Эйнштейн енгізді (1905). Эйнштейн Лоренц түрлендірулерін арнайы салыстырмалық теориясының негізі болған екі постулат бойынша қорытып шығарды: барлық инерциалдық санақ жүйесінің бірдейлігі және вакуумдағыжарық жылдамдығының жарық көзі қозғалысына тәуелсіздігі. Лоренц түрлендірулері.

Уақытың түрлендіруі.
К  К'
К'

Лоренц түрлендірулері.
18. Релятивистік динамика –– механиканың, жылдамдығы вакуумдағы жарық жылдамдығына жақын, дененің қозғалысын оқып-зерттейтін бөлімі.
 ,
,
Энергия (гр. energeіa – әсер, әрекет) – материя қозғалысының әр түрлі формасының жалпы өлшеуіші.Материя қозғалысының әр түрлі формалары бір-біріне айналып (түрленіп) отырады. 19 ғасырдың орта шенінде осы қозғалыстың барлық формалары бір-біріне белгілі бір сандық мөлшерде ғана айтылатындығы анықталды; осы жағдай “энергия” ұғымын енгізуге, яғни қозғалыстың әр түрлі физикалық формаларын бірыңғай өлшеуішпен өлшеуге мүмкіндік берді. “ Энергия” ұғымы сақталу заңына бағынады (қ. Энергияның сақталу заңы, Термодинамика). Қозғалыстың әр түрлі формасына сәйкес энергияның да бірнеше түрі бар (мысалы,механикалық энергия, химиялық энергия, электромагниттік энергия, гравитациялық энергия, ядролық энергия, т.б.) Энергия туралы ілімнің дамуындағы маңызды бір кезең үздіксіз ортадағы энергия қозғалысы мен “ энергия ағыны” туралы ұғымның енгізілуі болды. Энергия ағыны деп энергия тығыздығы мен берілген ортадағы орын ауыстыру жылдамдығының көбейтіндісіне тең векторды айтады.Кванттық физиканың дамуы энергия ның квантталатындығы жайлы, яғни кейбір жағдайда жүйенің энергия сы тек дискретті (үздікті) мәндерді ғана қабылдайды деген фактіні дәлелдеуге мүмкіндік берді. Мұндай жағдай мысалы, сәуле шығару энергия сына, микробөлшектердің тербеліс және айналу Энергиясына қатысты айтылады. Салыстырмалық теориясында Энергия (Е) мен масса (m) арасындағы байланыстың (Е=mс2, мұндағы с – вакуумдегі жарық жылдамдығы) ашылуы физика үшін зор маңызды болды. Бұл қатыс әмбебаб қатыс болып есептеледі. Сондықтан ол тіпті өте кішкентай микробөлшектің өзінде де әрқашан қозғалыстың белгілі бір түрі болатындығын көрсетеді. Мұндай қозғалыстың өлшеуіші mс2 өрнегі болады. Әсіресе бұл қатыстың ядр. энергетиканың дамуына байланысты іс жүзіндегі маңызы арта түсті. Энергия бірліктердің халықаралық жүйесінде (СИ) джоульмен, бірліктердің СГС жүйесінде эргпен өлшенеді. Ал ядролық және атомдық физикада энергияның өлшеу бірлігі ретінде электронвольт алынады.
19. Идеал газ – бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі.
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен – Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль–Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.[1]
Газдың температурасы төмендеген немесе оның тығыздығы артқан кезде идеал газ бөлшектерінің толқындық (кванттық) қасиеттері елеулі рөл атқара бастайды. Бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Бозе – Эйнштейн статистикасымен, ал жарты бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Ферми–Дирак статистикасыменсипатталады.
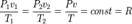
мұндағы R - меншікті газ тұрақтылығы. Мұндағы шамалар мына бірлікте: Р - Н/м2, v - м3/кг; Т - К, R - Дж/(кгК). Теңдеу біртекті газдардың қалай болса солай алынған санына m арналғанын, басқа түріндегі теңдеуін пайдалана отырып жазуға болады: 
Бұл теңдеу, идеалды газдарға арналған Клапейрон-Менделеев теңдеуі деп аталады. Мейлі, М газдың молярлы массасы, кг/моль, өлшенеді.
Авогадро заңы бойынша, идеалды газдың 10−3 көлемі - қандай да химиялық құрамындағы р және t бірдей кезінде, дәл өзі болады. Белгілі, қысым кезінде р0 = 101,33 Па (760 мм.сын.бағ.) және температурада T0=273,16К (нормалы физикалық күйде), газ көлемі 10−3моль кезінде, Vm = 22.4116 м3. р0, Vm, Т0 және M=m мәндерін теңдеуіне ауыстырып қойып табамыз:
 Дж/(моль*К)
Дж/(моль*К)
Мұндағы R* барлық газдар үшін бірдей және оны, эмбебапты газ тұрақтылығы деп атайды. Сонымен:

20. Изопроцестер деп үш параметрдің (Р, V, Т) біреуі тұрақты болғандағы басқа екі параметр өзгеретін процесті айтады. Газ күйін сипаттау және оның қасиеттерін қарастыру үшін үш шаманы пайдаланады. Р - қысым, V - көлем, Т – температура. Изопроцестер үшеу: изотермалық, изобаралық, изохоралық:
1.Тұрақты температурада термодинамикалық жүйе күйінің өзгеру процесі изотермалық процес деп атайды.
2. Тұрақты қысымда термодинамикалық жүйе күйінің өзгеру процесі изобаралық процес деп аталады.
3. Көлем тұрақты болғанда, температураның өзгеруінен туындайтын газ қысымының өзгеру процесін изохоралық процес деп атайды. Егер газдың температурасы өзгермесе, онда оның берілген массасы үшін газ қысымының көлемге көбейтіндісі тұрақты болады.
T=const: РV= const: Р1/Р2=V1/V2 Р1/V1=Р2/V2:
Бұл заңды тәжірибе жүзінде 1662 жылы ағылшын ғалымы Р. Бойль, одан біраз кейінірек 1676 жылы француз ғаламы Э. Мариотт ашты. Сондықтан ол Бойль - Мариотт заңы деп аталады.
2. Егер газ қысымы өзгермесе, берілген массалы газ үшін көлемнің температураға қатынасы тұрақты болады.
Р= const: V/T= const: V1/V2=T1/T2 V=V(1+at) V=V0аТ.
Бұл заңды 1802 жылы француз ғаламы Гей - Люссак тәжірибе жүзінде тағайындалған. Сондықтан ол Гей - Люссак заңы деп аталады.
Егер газ көлемі өзгермесе массасы берілген газ үшін қысымының температураға қатынасы тұрақты болады.
V= const: Р/Т = const: Р1/Р2=Т1/Т2; Р=Р0(1+at) Р=Р0aТ.
Бұл газ заңын 1787 жылы француз физигі Шарль ашқан. Сондықтан ол Шарль заңы деп аталады.
тұрақты температурада газ қысымының көлемге тәуелділігі график түрінде изотерма деп аталатын қисық сызық арқылы кескінделеді. V көлем мен Р қысым изотермалық процесс кезінде өзара кері пропорционал өзгеретіндіктен, мұндай изтерма гипербола деп аталады. Баромертлік формула: 
Еркін жол өзындығы, орташа еркін жол ұзындығы () — бөлшектердің өзі тәрізді басқа бөлшектермен тетелес екі соқтығысуы арасында жүріп өткен жолы. Соқтығысу түріне (серпімді, серпімсіз, т.б.) байланысты Е. ж. ұ. түрліше болып келеді. “Е. ж. ұ. ” ұғымы алғаш рет газдың кинетикалық теориясында қолданылды Е. ж. ұ. тұтқырлық, жылу өткізгіштік, диффузия, электр өткізгіштік тәрізді тасымалдау процестеріне байланысты есептерді шешкенде кеңінен қолданылады. Зарядталған бөлшектердің (электрондар мен иондардың) Е. ж. ұ-н қарастырғанда тиімді қима ұғымының мәні болмайды. ҙйткені иондар (электрондар) атомдармен (молекулалармен) қашықтан да әсерлесе береді.
21. Еркін жол өзындыұы, орташа еркін жол ұзындығы— бөлшектердің өзі тәрізді басқа бөлшектермен тетелес екі соқтығысуы арасында жүріп өткен жолы. Соқтығысу түріне (серпімді, серпімсіз, т.б.) байланысты Е. ж. ұ. түрліше болып келеді Е. ж. ұ. тұтқырлық, жылу өткізгіштік, диффузия, электр өткізгіштік тәрізді тасымалдау процестеріне байланысты есептерді шешкенде кеңінен қолданылады. Зарядталған бөлшектердің (электрондар мен иондардың) Е. ж. ұ-н қарастырғанда тиімді қима ұғымының мәні болмайды. ҙйткені иондар (электрондар) атомдармен (молекулалармен) қашықтан да әсерлесе береді.1860—1865 жылдары Максвелл электр және магнит өрістері туралы Фарадейдің идеялары негізінде және көптеген тәжірибелер нәтижелерін қорыта келе, зарядтар мен токтар жүйесі туғызатын электромагниттік өріс теориясын жасады. Электромагниттік өріс теориясының негізін Максвелл теңдеулері деп аталатын теңдеулер жүйесі құрайды.Электромагниттік өріс теориясын сипаттайтын теңдеулер жүйесін талдай отырып, Максвелл электромагниттік өріс кеңістікте электромагниттік толқын түрінде тарай алады деген теориялық болжам жасады. Максвелл теориясының негізінде жұлдыздар мен планеталарда, тіпті Әлем көлемінде өтіп жатқан, сондай-ақ микродүниедегі, атомдар ішінде өтетін сан алуан құбылыстарды түсініп, сипаттау мүмкін болды. Максвелл теориясынан айнымалы электр және магнит өрістерінің арасындағы үзілмейтін байланыс ашылғаннан кейін, материяның ерекше түрі — электромагниттік өрістің бар екені айқындалды. Бұл өрістердің бір-бірінен жекеленіп, тәуелсіз түрде пайда бола алмайтыны анықталды. Максвеллдің пікірінше, айнымалы электр өрісі әрқашан айнымалы магнит өрісін тудырады.
Газ температурасы белгiлi болса, онда оның молекуласының қозғалысының орташа түзу сызықты жылдамдығын есептеуге болады.  теңдеуiмен орташа кинетикалық энергия анықтамасынан
теңдеуiмен орташа кинетикалық энергия анықтамасынан  теңдiгiмен теңестiрiп жылдамдықтың орташа квадраты үшiн келесi өрнектi аламыз:
теңдiгiмен теңестiрiп жылдамдықтың орташа квадраты үшiн келесi өрнектi аламыз:  . Бұл шамадан алынған квадраттық түбiр орташа квадраттық жылдамдық деп аталады:
. Бұл шамадан алынған квадраттық түбiр орташа квадраттық жылдамдық деп аталады:

Идеал газ молекуласының жылдамдық бойынша таралу функциясы максимал болған кездегі жылдамдықты ең ықтимал жылдамдық  деп атаймыз.
деп атаймыз.
 нольге теңестіріп, аламыз.
нольге теңестіріп, аламыз.
 .
.
Температураның өсуімен  өседі.
өседі.
Газ молекуласының орташа жылдамдығы (орташа арифметикалық жылдамдық).
 .
.
22. Тасымалдау Құбылыстары – физикалық жүйеде электр заряды, масса, импульс, энергия, энтропияның, т.б. физикалық шамалардың кеңістікте тасымалдануы (бөлінуі) арқылы өтетін кинетикалық процестер. Жүйеге сыртқы электр өрісінің әсер етуі нәтижесінде, жүйе температурасының құрамының және жүйені құрайтын бөлшектердің (атом, молекула) орташа жылдамдығының кеңістіктік біртекті болмауы салдарынан да Тасымалдау Құбылыстары пайда болады. Физ. шамалардың тасымалдануы олардың градиентіне кері бағытта жүреді.
Тасымалдау Құбылыстары жүйені тепе-теңдік күйге жақындатады. Тасымалдау Құбылыстарына электрөткізгіштік (сыртқы электр өрісінің әсерінен электр зарядтарының тасымалдануы және айқас процестер), диффузия (концентрация градиентіне байланысты жүйенің бір бөлігінен екінші бөлігіне массаның тасымалдануы), жылуөткізгіштік(темп-ра градиенті нәтижесінде жылу энергиясының жүйенің бір бөлігінен екіншісіне тасымалдануы), т.б. құбылыстар жатады. Айқас процестер кезінде бір шаманың градиенті басқа шаманың тасымалдануына әкеледіСыртқы магнит өрісі әсер етпейтін изотроптық жүйелерде термоэлектрлік эффектілер деп аталатын айқас құбылыстар байқалады: екі тізбектеп қосылған әр түрлі өткізгіштердің түрлі темп-радағы түйіндерінде электр тогы жоқ кезде электр қозғаушы күштің (ЭҚК) пайда болуы (Зеебек эффектісі); Пельте эффектісі – тұрақты температурадағы әр түрлі екі өткізгіштің түйіндерінен электр тогы өткенде жылудың бөлінуі немесе жұтылуы; Томсон эффектісі – тогы бар өткізгішті бойлай темп-ра градиенті болғанда жылудың бөлінуі немесе жұтылуы. Тасымалдау Құбылыстарын кинетик. теория зерттейді.
23. Молекуланың еркін дәрежелер саны. Энергияның еркін дәрежелерге біркелкі бөліну заңы
Термодинамикалық жүйенің ең маңызды сипаттамаларының бірі ішкі энергия U болып табылады. Ол жүйедегі микробөлшектердің (молекула, атом, электрон, ядро, т.б.) хаосты (жылулық) қозғалысының және осы бөлшектердің өзара әсерлесу энергиясы болып табылады. Біртұтас жүйенің қозғалысының кинетикалық энергиясы мен сыртқы өрістегі жүйенің потенциалдық энергиялары ішкі энергия болып есептелінбейді.Ішкі энергия – жүйенің термодинамикалық күйінің функциясы, демек жүйенің әр күйде белгілі бір ішкі энергиясы болады. Жүйе бір күйден екінші бір күйге өткенде оның ішкі энергиясының өзгерісі сол күйлердің ішкі энергияларының айырмасымен анықталады.Жүйенің ішкі энергиясының өзгерісі жүйе бір күйден екінші күйге қандай жолмен келгеніне тәуелсіз шама болып табылады. Еркін (еріктілік) дәрежелер саны деп жүйенің кеңістіктегі орнын толықтай анықтайтын тәуелсіз айнымалылар (координаталар) санын айтады. Термодинамиканың бірінші бастамасы (заңы).. Жүйенің ішкі энергиясы түрлі процестер нәтижесінде өзгеруі мүмкін:
1) жұмыс жасау арқылы;
2) жылу беру (қыздыру) арқылы.
Механикалық қозғалыс энергиясы жылулық қозғалыстың энергиясына және керісінше ішкі энергия механикалық қозғалыс энергиясына айнала алады. Бұл айналуларда энергияның бір түрден екінші түрге айналу және сақталу заңы орындалады. Термодинамиканың 1 заңы термодинамикалық процестерге қатысты энергияның сақталу заңы болып табылады. Термодинамиканың 1 заңы көптеген тәжірибелердің нәтижесі Жүйеге берілетін жылу мөлшері және жүйе сыртқы күштерге қарсы жасайтын жұмыс оң шама болып есептелінеді.Жүйенің алатын жылу мөлшері Q мен сыртқы күштерге қарсы жасалатын жұмыстың А айырымына тең болады. Еркіндік дәрежесінің саны -Серпімді жүйелердің тербелістерін зерттеу кезінде уақыттың әрбір сәтінде жүйенің орнын табудағы тәуелсіз параметрлер саны.
Больцман заңы – тепе-тең сәуле шығарудың толық көлемдік тығыздығының (r) (r=аT4, а-тұрақты шама) және соған байланысты дененің толық сәуле шығарғыштық қабілетінің (u) (u=sT4, мұндағы s – Стефан-Больцман тұрақтысы), абсолют температураның (T) төртінші дәрежесіне пропорционал екендігін тұжырымдайтын заң. Бұл заңды 1879 жылы австриялық физик Й.Стефан тәжірибелік деректерге сүйеніп, кез келген дененің сәуле шығарғыштық қабілеті үшін өрнектеп берді. Бірақ кейінгі жүргізген өлшеулер қорытындысы Стефан-Больцман заңының тек абсолют қара дененің сәуле шығарғыштық қабілеті үшін ғана орындалатындығын көрсетті. 1884 жылы Стефан-Больцман заңын Л.Больцман (1844 – 1906) теория жолмен қорытып шығарды. Алайда a және s тұрақтыларының мәнін теория жолмен тек Планк заңының негізінде ғалына анықтауға болады, өйткені Стефан-Больцман заңы Планк заңының салдары ретінде шығады. Стефан-Больцман заңы жоғары температураны өлшеу кезінде пайдаланылады.
Термодинамика негізінен термодинамиканың бірінші және екінші заңдары деп аталатын екі заңдылыққа сүйенеді. Олардың екеуі де өмірдегі, өндірістегі тәжірибелерді жинақтап, қорытып, тұжырымдаудан пайда болған. Термодинамика мынадай тараулардан тұрады: энергияның бір түрден екіншіге түрленуіндегі жалпы заңдылықты зерттейтін жалпы немесе физикалық термоди-намика, жылу машиналарындағы жылу мен механикалық жұмыстың өзара айналуын, яғни жылудын, жұмысқа, жұмыстьщ жылуға ауысуын қарастыратын техникалық термодинамика, химиялық ре-акция, еру, кристалдану, адсорбция сияқты процестердегі энергия түрлерінің өзара алмасуын, айналуын анықтап, есептейтін химиялық термодинамика. Сол сияқты, химиялық термодинамика тек химиялық және басқа да энергиялардағы ара қатынасты зерттеп қана қоймай, белгілі жағдайдағы химиялық процестердің мүмкіндігі мен өздігінен жүру шегін айқындайды. Термодинамикалық әдістегі есептеулерді қолдану өндірістің барлық салаларына өз ықпалын тигізіп, оларды жаңа сатыға кө-тердіЖылу сыйымдылығы — дене температурасын 1°С-ге немесе 1 калорияға жоғарылату үшін берілетін жылу мөлшері. Массаның жылу сыйымдылығының бірлігі меншікті жьлу сыйымдылығы деп аталады. Жылу сыйымдылығының қысымы тұрақты газдар үшін С және көлемі тұрақты газдар үшін С болып ерекшеленеді. Бірінші жағдайда дененің жьлулық ұлғаюына байланысты (дененің геометриялық өлшемдерінің өзгеруіне) сыртқы күштерге қарсы механикалық жұмыс жасалады, ал екінші жағдайда дененің жылуы кезінде оның геометриялық өлшемдері өзгермейді және энергиясын ұлғайтуға жұмсалады. Қысымтұрақты болған кездегі жылу сыйымдылығы көлемі тұрақты болған кездегі жылу сыйымдылығынан үнемі артық боладыМеншікті жьшу сыйымдылығының дененің тығыздығына көбейтіндісі көлемдік жылу сыйымдылығы деп аталады.Термодинамиканың бiрiншi заңын изопроцестерге қолдану туралы қазақша реферат
Изохоралық процесс. Бұл процесте газ көлемi өзгермейдi: V = const. Газдың iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең: ΔU = Q. Егер газ қыздырылса, онда Q > 0 және ΔU > 0 – iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның iшкi энергиясы азаяды.
Изотермалық процесс. Изотермалық процесс кезiнде газдың температурасы тұрақты болады (Т = const) және оның iшкi энергиясы өзгермейдi. Газға берiлген барлық жылу мөлшерi пайдалы жұмыс атқаруға жұмсалады: Q = А′. Газ белгiлi жылу мөлшерiн (Q > 0) алған кезде, ол оң жұмыс атқарады (А′ > 0). Керiсiнше, егер газ қоршаған ортаға жылу берсе, онда оның атқарған жұмысы терiс болып саналады.
Изобаралық процесс. Изобаралық процесс кезiндегi газға берiлген жылу мөлшерi оның iшкi энергиясының бiрге өзгеруiне және қысым тұрақты болған кездей P = const жұмысты атқаруға шығындалады.
Адиабаталық процесс. Қоршаған ортамен жылу алмасуы болмайтын жағдайда өтетiн жүйедегi изопроцесс адиабаталық процесс деп аталады.
Адиабаталық процесс кезiнде Q = 0 және жүйенiң iшкi энергиясының өзгеруi жұмыс атқару арқылы ғана жүредi: ΔU = А. ΔU = А теңдiгi белгiлi қорытынды жасауға мүмкiндiк бередi.
25. Дөңгелек процесс (цикл). Қайтымды және қайтымсыз процестер
Дөңгелек процесс немесе цикл деп жүйе бірнеше күйден өтіп барып бастапқы күйге қайта оралу процесін айтады. Циклдің диаграммасы тұйық қисық. Идеал газдың циклін 2 процеске бөлуге болады.
1. Газдың ұлғаюы (1-2);
2. Газдың сығылуы (2-1).
Егер цикл ішінде оң жұмыс жасалса A = >0, онда цикл сағат тілімен бағыттас жүреді, тура цикл деп аталады. Ал егер цикл ішінде жасалатын жұмыс теріс A = <0 болса, цикл сағат тіліне қарсы бағытта болады да, кері цикл деп аталады.Кері цикл
Тура цикл жылу двигательдерінде қолданылады. Жылу двигательдері деп жұмысты сырттан алынған жылу арқылы периодты түрде жасайтын двигательдерді айтады. Кері цикл салқындатқыш машиналарда қолданылады. Салқындатқыш машиналар деп сыртқы күштердің жұмысы арқылы жылу температурасы төмен денеден жоғары денеге берілетін машиналарды айтады. Дөңгелектік процесс нәтижесінде жүйе бастапқы күйіне қайта оралады, яғни ішкі энергияның толық өзгерісі нульге тең. Дөңгелек процесс үшін термодинамиканың 1 заңын жазайық:
Q = ΔU + А, ΔU = 0, бұдан Q = А,
Термодинамикалық жүйе 1 күйден 2 күйге өткен кезде бір параметрдің мәні өзгеретін процесті термодинамикалық процесс деп атайды.
Егер термодинамикалық процесс кезінде жүйе 1 күйден 2 күйге, яғни i – күйлерден өтсін делік, жүйе i – күйлерден және 2 күйден өтіп, 1 күйге қайта айналып келсе, жүйеде және оны қоршаған ортада ешқандай өзгеріс байқалмаса, ондай процесті қайтымды процесс деп атайды.
Егер жүйе бір күйден екінші күйге өткенде жүйенің өзінде, не болмаса қоршаған ортада өзгеріс болса, ондай процесті қайтымсыз процесс деп атайды. Өмірдегі процестердің бәрі қайтымсыз процесс болып саналады.
Энтропия. Энтропия түсінігін алғаш енгізген Клаузиус. Кез-келген қайтымды процесс кезінде денеге берілетін келтіріген жылу мөлшері нольге тең.Тұйық интегралдың нольге тең болуы интегралданып тұрған шамасы бір функцияның толық дифференциалы екендігін көрсетеді. Дифференциалы ға тең күй функциясы энтропия деп аталады және S-пен белгіленеді.
Термодинамикада қайтымды процесс үшін: ΔS = 0,
ал қайтымсыз процесс үшін өседі: ΔS > 0.
Бұл өрнектерді біріктіріп, Клаузиус теңсіздігін алуға болады: ΔS ≥ 0.
Жазылған өрнектер тұйық жүйелер үшін де орындалады. Тұйық жүйенің энтропиясы өседі (қайтымсыз процесс) немесе тұрақты болады (қайтымды процесс). Идеал газ процесіндегі энтропияның өзгерісін қарастырайық.
dU = CV dТ,
δА = рdV
Не нашли, что искали? Воспользуйтесь поиском: