
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Решения Республика 2002 год
XL Республиканская олимпиада школьников по химии
Учебный год.
Задания для 11 класса.
Задача 1.
Расшифруйте цепочку превращений:

Дополнительно известно, что вещество С применяется в кулинарии и при консервировании, вещество Е является компонентом свекловичного сока, вещество F широко используется в органическом синтезе.
Задача 2.
Предложить методику, укажите необходимую химическую посуду для разделения смеси, содержащей железную стружку, медные и свинцовые опилки, капли ртути, иодид серебра, петролейный эфир, пропиловый спирт, нитрат калия, гранулы пенополистирола.
Задача 3.
В химии важно знать концентрации всех частиц в растворе кислоты, основания или соли после установления равновесий, связанных с диссоциацией, гидролизом или осаждением слабых электролитов, в частности концентрацию ионов водорода
(рН раствора). рН = –lg[H+], где [H+] – равновесная концентрация ионов водорода.
К 100 мл раствора уксусной кислоты с титром (титр – число граммов растворенного вещества в одном миллилитре растворителя) Т = 0,006 г/мл добавили 100 мл раствора гидроксида натрия с процентной концентрацией 0,4% (плотность такого раствора можно принять за единицу).
?1. Рассчитайте молярные концентрации (число молей растворенного вещества в одном литре растворенного вещества) исходных веществ.
?2. Рассчитайте рН раствора, полученного после сливания щелочи и кислоты, если известно, что константа диссоциации уксусной кислоты Ка = 1,8´10-5 (рКа = 4,75).
Задача 4.
В аналитическую лабораторию принесли образец крупнокристаллической фиолетовой соли А для установления её состава. Лаборантом были взяты три одинаковые навески А массой 1.0000г.
Первую навеску он поместил в фарфоровую чашечку и прокалил в муфельной печи. Масса навески уменьшилась до 0.5671г, но при длительном стоянии на воздухе вновь стала постепенно увеличиваться.
Две другие навески были растворены в 5,00 мл воды каждая. При добавлении к первому раствору 6.45 мл 5.00% раствора гидроксида калия (плотность 1.044 г/мл) образовался осадок, который полностью растворился в избытке щёлочи.
К раствору второй навески химик прилил небольшой избыток раствора хлорида бария. Выпавший белоснежный осадок, нерастворимый в кислотах, он отфильтровал, высушил до постоянной массы и взвесил. Масса осадка составила 0.9339 г.
Полученных данных аналитику оказалось достаточно, чтобы определить состав соли.
?1. Объясните, какие компоненты исследуемой соли были определены лаборантом в ходе каждой из описанных выше операций, запишите уравнения соответствующих реакций.
?2. Определите состав соли, взятой для анализа.
Решения Республика 2002 год
Задачи 11 класса
Задача 1. В основе цепочки лежат следующие уравнения реакций:
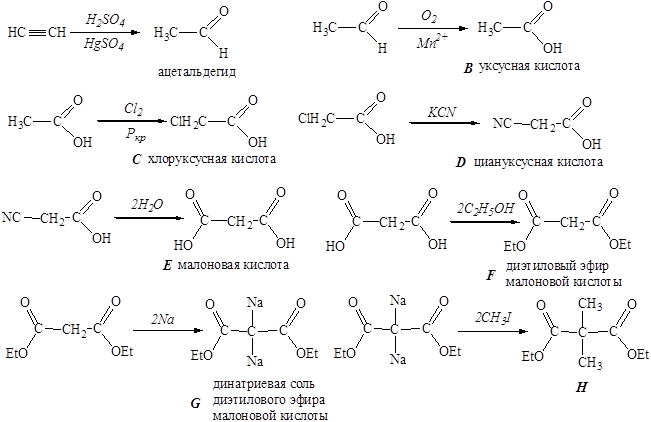 Задача 2. К данной смеси добавляем воду. В осадке: Fe, Cu, Pb, Hg, AgI. В растворе: пропиловый спирт, нитрат калия. Над водной фазой: петролейный эфир, гранулы пенополистирола.
Задача 2. К данной смеси добавляем воду. В осадке: Fe, Cu, Pb, Hg, AgI. В растворе: пропиловый спирт, нитрат калия. Над водной фазой: петролейный эфир, гранулы пенополистирола.
1) Методом декантации сливаем (разделяем) водно-спиртовый и органический слои с гранулами пенополистирола.
2) Фильтрованием отделяем гранулы пенополистирола.
3) В делительной воронке отделяем петролейных эфир от водного раствора.
4) Отгоняем водно-спиртовую смесь. Сухой остаток – нитрат калия.
5) Перегоняем пропиловый спирт с последующим осушением возможной азеотропной смеси поглотителем воды (CaCl2, P2O5, молекулярные сита).
6) Из осадка, содержащего Fe, Cu, Pb, Hg, AgI магнитом отделяем железную стружку.
7) К оставшейся части осадка добавляем водный раствор аммиака. AgI переходит в раствор в виде комплекса [Ag(NH3)2]I. Раствор упариваем и подкисляем азотной или серной кислотой. Отфильтровываем осадок иодида серебра.
8) Оставшуюся смесь, содержащую Cu, Pb, Hg прокаливаем для удаления паров ртути. Контроль за полнотой удаления проводим при помощи холодной пластинки стекла, которую держим непосредственно над нагреваемой смесью.
9) Медь и свинец разделяем, используя разницу в их температурах плавления. Первым плавится свинец, его удаляем «горячим» фильтрованием.
Медь остается.
Задача 3.
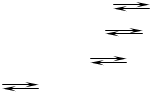 CH3COOH + NaOH CH3COONa + H2O (1)
CH3COOH + NaOH CH3COONa + H2O (1)
CH3COONa + H2O CH3COOН + NaOH (2)
CH3COO- + H2O CH3COOH + OH- (3)
H2O H+ + OH- (4)
Образующаяся по уравнению 1 соль CH3COONa (ацетат натрия) подвергается гидролизу (уравнение 2).
Рассчитаем молярные концентрации исходных веществ.
Для уксусной кислоты: 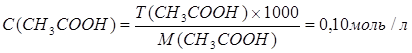
n (CH3COOH) = С ´ V= 0,1 моль/л ´ 0,1 л = 0,01 моль.
Для гидроксида натрия:
V (раствора) = 100 г.
 , отсюда
, отсюда 
Теперь рассчитаем молярную концентрацию: 
С (NaOH) = 0,1 моль/л; n (NaOH) = С ´ V= 0,1 моль/л ´ 0,1 л = 0,01 моль.
n (CH3COOH) = n (NaOH) = n (CH3COONa)
Рассчитаем концентрацию ацетата натрия c учетом разбавления: 
Выведем уравнение для расчета рН.
Константа равновесия реакции 2 – это константа гидролиза.  ,Умножим числитель и знаменатель на [H+]:
,Умножим числитель и знаменатель на [H+]:
 , здесь:
, здесь: 
KH2O = 1´10-14, pKH2O = 14, pKH2O = pH + pOH = 14; 
Получаем: 
Соответственно можно записать: 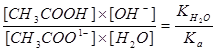
Концентрация [H2O] = 1 моль/л, т.к. вода – растворитель, взятый в избытке.
По уравнению (3) [CH3COOH] = [OH-], поэтому можно записать:  , отсюда:
, отсюда: 
[CH3COO-] = С (CH3COONa) = 0,05 М, [OH–] = 5,27´10-6.
рОН = -lg [OH-] = -lg(5,27´10-6) = 5,275 рН = 14 – рОН = 14 – 5,275 = 8,725.
Задача 4. По всей видимости, А представляет собой некий кристаллогидрат. При нагревании соли удаляется кристаллизационная вода (это подтверждается и тем, что первая навеска после прокаливания снова набирает вес). Таким образом, 1.0000г А содержит 0.4329г или 24.05´10-3моль, воды.
Образование осадка, растворяющегося в избытке щёлочи, свидетельствует о том, что в состав А входит катион амфотерного элемента, скорее всего — хрома (III) (аквакомплексы бериллия, алюминия, цинка или свинца не окрашены).
Найдём массу и количество хрома в 1.000 г А:
m(раствора КОН) = 6.45мл´1.044г/мл = 6.7338г,
m(КОН) = 6.7338г´0.05 = 0.3367г,
n(КОН) = 0.3367г:56г/моль = 6.012´10-3моль,
n(Cr3+) = n(Cr(OH)3) = 6.012:3 = 2.004´10-3моль,
m(Cr3+) = 2.004´10-3моль´52г/моль = 0.1042г.
Осадок, выпадающий при взаимодействии А с хлоридом бария — BaSO4, т. е. в состав соли входит сульфат-анион.
n(SO42-) = n(BaSO4) = 0.9339г:233г/моль = 4.008´10-3 моль
m(SO42-) = 4.008´10-3 моль´96г/моль = 0.3848г.
Из сравнения соотношения n(Cr3+):n(SO42-) видно, что заряды катионов и анионов не скомпенсированы, и в состав соли должен входить еще один катион. Поскольку осадка при действии КОН он не образует, это катион щелочного металла.
n(M+) = 2n(SO42-) — 3n(Cr3+) = 2.004´10-3моль.
m(М+) = 1.000—0.4329—0.1042—0.3848 = 0.0781г.
А(М+) = 0.0781г: 2.004´10-3моль = 39.0 г/моль, что соответствует атомной массе калия.
K+:Cr3+:SO42-:H2O = 2.004:2.004:4.008:24.05 = 1:1:2:12. Таким образом, А — это хромокалиевые квасцы KCr(SO4)2´12H2O или K2SO4´Cr2(SO4)3´24H2O.
| <== предыдущая лекция | | | следующая лекция ==> |
| Что называется методологией исследования? | | | XLII Республиканская олимпиада школьников по химии |
Не нашли, что искали? Воспользуйтесь поиском: