
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задания для 11 класса (решения).
Задача 1 (автор – Курамшин А.И.)
!1. Под атомной эффективностью и атомной экономией подразумевается переход максимально большего числа атомов из исходных веществ в состав целевого продукта. Экономия атомов достигается не только за счет снижения доли побочных продуктов, но и за счет уменьшения доли продуктов реакции, образующихся по «основному» пути реакции. Так, наиболее «экономными» и «эффективными» являются реакции присоединения/полимеризации – все атомы исходных реагентов присутствуют в продукте.
!2. Переход к малостадийным синтетическим процессам, использование хемо-, регио- и стереоселективных синтетических методов, связанных с использованием каталитических методов. Использование реакций без растворителей (solvent-free reactions). Использование последовательных реакций в одном реакционном сосуде без выделения промежуточных соединений (one pot synthesis).
!3.
 |
Найлоны представляют собой продукты поликонденсации дикарбоновых кислот и диаминов. Нумерация в коммерческом названии найлонов представляет число атомов соответственно в кислоте и диамине. Получение найлона-6,6 (А – адипиновая кислота):
!4.
 |
Расшифровка схемы превращения:
Вещество Н (основной продукт окисления циклогексана кислородом на ванадиевом катализаторе или продукт присоединения воды к циклогексену) – циклогексанол.
!5.
 |
Уравнение окисления циклогексанона азотной кислотой (с коэффициентами):
На 1 моль адипиновой кислоты выделяется 6 моль оксида азота(IV), можно рассчитать, что на 2200000 тонн годового объема производства адипиновой кислоты образовывалось примерно 5063000 тонн диоксида азота.
!6. Диоксид азота, попадая в атмосферу, приводит к образованию «кислых дождей»:
2NO2 + H2O = HNO3 + HNO2 или
4NO2 + 2H2O + О2= HNO3
Также оксида азота(IV) вносит свой вклад в создание «парникового эффекта» и в разрушение озонового слоя.
Метод, предложенный Нойори, содержит на одну стадию меньше, чем «классический», при его реализации образуется гораздо меньше побочных продуктов (NB – в «классическом» только 5% продукта окисления циклогексана может быть сразу окислена в адипиновую кислоту). Единственное вещество, которое образуется помимо адипиновой кислоты в методе Нойори – вода, которая не представляет опасности для окружающей среды.
Задача 2 (авторы – Зиганшин М.А. Зиганшина С.А.)

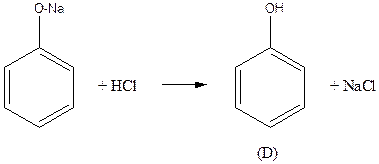
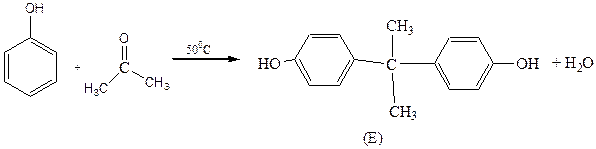
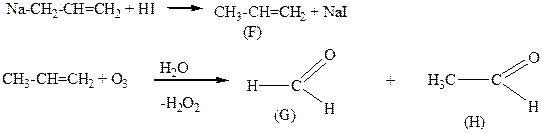
A – (аллилокси)бензол
B – фенолят натрия
C – аллилнатрий
D – фенол
E – 4,4`–диоксидифенилпропан (Диан)
F – пропен
G – метаналь
H – этаналь
3. Алкилированные фенолы используются как антиоксиданты.
4. 40% раствор формальдегида – формалин
Задача 3 (авторы – Зиганшин М.А. Зиганшина С.А.)
1. Запишем уравнение гидролиза:
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
Структурные формулы:

2.По условию реакция протекает при большом избытке воды, следовательно изменением концентрации воды в ходе реакции можно пренебречь. Тогда скорость реакции будет пропорциональна только концентрации сахара, следовательно порядок реакции равен 1.
3. Константа реакции первого порядка рассчитывается по уравнению (1):
k= 1/τ * ln C0сахара/(С0сахара-х),
Где C0сахара – начальная концентрация сахара, С0сахара-х – концентрация сахара в момент времени τ.
Обозначим через ά0 άх и άτ угол вращения света в начальный, конечный и любой момент времени τ соответственно. Изменение угла вращения ά0 - άх определяется начальной концентрацией сахара С0сахара. Изменение концентрации сахара на х приводит к изменению угла вращения на величину ά0 - άτ Тогда концентрация сахара в любой момент С0сахара – х будет пропорциональна ά0 - άх – (ά0 -άτ)= άτ - άх
Можно преобразовать уравнение (1) к виду:
k= 1/τ * ln (ά0 - άх) /(άτ - άх),
Используем данные, приведенные в условии задачи:
k= 1/108 * ln (25,16 – (-8,38)) /(11,1 – (-8,38))= 0,00503 мин-1
2. Воспользуемся уравнением (1):
0,005031= 1/200* ln C0сахара/(С0сахара-х)
Получим ln C0сахара/(С0сахара-х)=1,0062 C0сахара/(С0сахара-х)=2,735 х=0,634* С0сахара или 63,5%
5. Когда весь исходный сахар гидролизуется (100%) изменение угла вращениясоставит
25.160-(-8.380) = 33.540
К моменту времени t = 200 минут осталось 100% – 63.4% = 36.6% сахара, не подвергшегося гидролизу. Инверсия этого сахара вызовет изменение угла вращения равное y 0.
Составим пропорцию
100% – 33.540
36.6% – y 0
y 0 = 36.64%*33.540/100% = 12.280
Т.к. y 0 = a200 – a¥, получим a200 = 12.280 – 8.380 = 3.90 (Раствор имеет правое вращение)
6. Увеличение температуры приведет к увеличению скорости гидролиза, уменьшение –наоборот.
Задача 4 (автор – Ефимов М.В.)
Чтобы не перегреться на солнцепеке, верблюд вынужден интенсивно потеть. Лишь за счет испарения воды с поверхности кожи и легких ему удается поддерживать температуру тела неизменной. При окислении (сгорании) жира действительно образуются значительные количества воды. Процесс окисления, однако, сопровождается выделением громадного количества тепла, которого, к сожалению для верблюда, хватило бы на то, чтобы разогреть всю получившуюся воду до кипения, а затем её и испарить. Так, что толку, от такого способа получать воду, верблюду никакого.
Подтвердим все сказанное расчетами:
«Усредненную» формулу верблюжьего жира можно представить в виде:

В данной структуре содержится:
СН2 – 46 групп
СН3 – 3 всего 104 С–Н связи
СН – 3
С=С – 1 связь
С–О – 6
С=О – 3
С–С – 51
Теплоту сгорания рассчитываем по аддитивной схеме, пользуясь табличными данными:
Q = ∑n*Qсгор., где n – количество связей данного типа, Qсгор. – константа данной ковалентной связи.
Q = 104*226,1 + 1*491,5 + 6*41,9 + 3*56,5 + 51*206,4 = 34953,2 (кДж/моль)
Такое количество теплоты выделяется при окислении одного моля «усредненного» жира.
Нетрудно вычислить, что при окислении моля жира выделяется 52 моль воды.
Рассчитаем, какое количество тепла может «унести» с собой это количество воды при испарении:
Нагрев от 38 до 1000С:
Q1 = n(Н2О)*Ср*DТ
Q1 = 52*75,3*(100–38) = 242767 Дж
Испарение 52 моль воды:
Q2 = n(Н2О)* ΔНисп
Q2 = 52*40,7 = 2116,4 кДж
Всего при испарении 52 моль воды можно «избавиться» от 242,8+2116,4 = 2359,2 кДж тепла.
В процессе образования этой воды выделилось почти 35000 кДж тепла.
Понятно, что компенсировать такую теплоотдачу выделившейся водой, невозможно!
Не нашли, что искали? Воспользуйтесь поиском: