
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Уравнение Ван-дер-Ваальса и его анализ
СВОЙСТВА РЕАЛЬНЫХ ГАЗОВ
Уравнение Ван–дер–Ваальса:

где постоянные поправки а и b зависят от природы газа.
Поправка b учитывает объем, недоступный для движения молекул в силу конечности объема самих молекул и наличия взаимодействия между ними. Величина b составляет примерно учетверенный объем самих молекул.
Поправка а учитывает силы взаимного притяжения. Полагая, что внутреннее давление газа изменяется пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема газа, Ван-дер-Ваальс принял его равным а/J2, где а – коэффициент пропорциональности.
Раскрывая скобки в левой части:

Умножая равенство на J2 и разделив на р:

Полученное уравнение имеет три корня, т.е. при заданных параметрах р и Т имеется три значения переменной J, которые превращают уравнение в тождество.
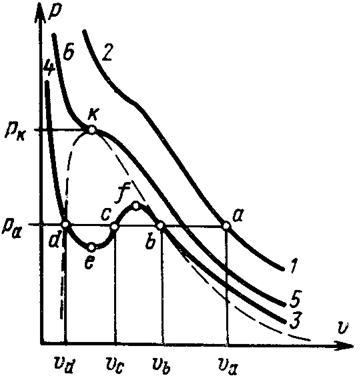
Рассмотрим в системе координат р–J изотермы, построенные по уравнению Ван-дер-Ваальса.
 Первый случай имеет место при высоких температурах, когда изотермы имеют вид кривых гиперболического характера (линия 1-2). Каждому давлению соответствует определенный удельный объем (давлению ра соответствует удельный объем Jа). Тело в этом случае при любых давлениях находится в газообразном состоянии.
Первый случай имеет место при высоких температурах, когда изотермы имеют вид кривых гиперболического характера (линия 1-2). Каждому давлению соответствует определенный удельный объем (давлению ра соответствует удельный объем Jа). Тело в этом случае при любых давлениях находится в газообразном состоянии.
 Второй случай имеет место при сравнительно низких температурах, когда изотермы имеют два перегиба (линия 3-4).
Второй случай имеет место при сравнительно низких температурах, когда изотермы имеют два перегиба (линия 3-4).
В этом случае между точками e и f находится область, в которой каждому давлению соответствует три значения удельного объема (давлению ра соответствуют удельные объемы Jb, Jс и Jd), которые и являются тремя действительными и различными корнями уравнения Ван-дер-Ваальса.
Участок 3-b соответствует изотермическому сжатию тела,  находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние.
находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние.
Точка d соответствует такому состоянию тела, когда оно уже полностью превратилось в жидкость, в соответствии с чем участок d-4 представляет собой изотермическое сжатие жидкости.
Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f соответствует неустойчивому состоянию пара, а участок d-e – неустойчивому состоянию жидкости.
 Что касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояния при постоянном давлении, т.е. по горизонтальной линии b-d.
Что касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояния при постоянном давлении, т.е. по горизонтальной линии b-d.
 Третий случай имеет место при определенной для каждого тела температуре, когда точки b и d, сближаясь с повышением температуры, сливаются в одну точку k, в которой имеет место перегиб соответствующей изотермы, причем касательная к ней в этой точке имеет горизонтальное направление.
Третий случай имеет место при определенной для каждого тела температуре, когда точки b и d, сближаясь с повышением температуры, сливаются в одну точку k, в которой имеет место перегиб соответствующей изотермы, причем касательная к ней в этой точке имеет горизонтальное направление.
Точка k называется критической точкой, выше которой невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние, а соответствующие ей параметры ркр, Jкр и Ткр называются критическими параметрами.
Аналитически условия критического состояния тела выражаются уравнениями

Первое из них показывает, что критическая изотерма в точке k имеет горизонтальную касательную, второе – что изотерма имеет в точке k перегиб.
Используя эти уравнения совместно с уравнением состояния, можно определить значения критических параметров состояния газа.
Критические параметры определяются следующим образом.
Преобразуем уравнение Ван-дер-Ваальса:

Дифференцируем:

Определяем вторую производную:

Разделив первое уравнение на второе

и, следовательно  ,
, 
Далее, подставляя в уравнение Ван-дер-Ваальса, получаем:
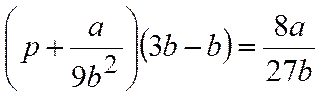
откуда 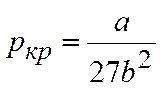
Уравнение Ван-дер-Ваальса можно представить в безразмерном виде с подстановкой:

Подставляя в уравнение Ван-дер-Ваальса:

или 
Окончательно 
Уравнение Ван-дер-Ваальса в безразмерном виде показывает, что если у разных газов два приведенных параметра имеют одинаковое значение, то одинаковым будет и третий параметр.
Состояния разных газов, при которых их приведенные параметры  равны, называются соответственными состояниями.
равны, называются соответственными состояниями.
Реальные газы, находящиеся в соответственных состояниях, являются термодинамически подобными.
Если из данных эксперимента известны свойства какого-либо реального газа, то по ним без всякого эксперимента можно определить аналогичные свойства любого другого газа, находящегося с ним в соответственном состоянии.
Не нашли, что искали? Воспользуйтесь поиском: