
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема 1. Атомно-молекулярное учение. Основные химические понятия и законы
ХИМИЯ
Методические указания к выполнению контрольных работ
Контрольная работа выполняется в отдельной тетради. Номера и условия задач переписываются в порядке, указанном в контрольной работе. В конце работы приводится список использованной литературы. Работа подписывается студентом с указанием даты.
Если контрольная работа не зачтена, ее нужно выполнить повторно. Исправления следует выполнять в конце тетради.
Таблица вариантов контрольных заданий приведена в конце пособия. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается, как сданная.
КОНТРОЛЬНОЕ ЗАДАНИЕ № 1
Тема 1. Атомно-молекулярное учение. Основные химические понятия и законы
Создание атомно-молекулярного учения относится к концу XVIII – началу XIX века. Основные положения этой теории перчислены ниже.
1. Вещества состоят из молекул; молекулы различных веществ различаются между собой химическим составом, химическими и физическими свойствами.
2. Молекулы находятся в непрерывном движении. Скорость движения зависит от агрегатного состояния вещества.
3. В ходе химических реакций образуются новые вещества, молекулы которых имеют иной качественный и количественный состав.
4. Молекулы состоят из атомов. Свойства атомов одного элемента одинаковы, и отличаются от свойств атомов других элементов.
Атом – мельчайшая частица химического элемента, сохраняющая его свойства. Молекула состоит из атомов, связанных химическими связями. Молекула является мельчайшей частицей вещества, обладающей его свойствами. За единицу количества вещества в химии принято такое количество вещества, которое содержит 6,02∙1023 структурных единиц. Эта единица количества вещества называется молем (n), а число 6,02∙1023 числом Авогадро.(NA). Массу одного моля вещества называют молярной массой вещества(М). Она численно равна молекулярной массе вещества. Моль, масса и молярная масса вещества связаны между собой.
n = m/M
| где: | n | — количество вещества (моль); |
| m | — масса вещества в граммах; | |
| M | — молярная масса вещества в г/моль. |
а также n = n/NA
| где: | n | — количество вещества (моль); |
| n | — число молекул; | |
| NA | — число Авогадро (моль-1). |
Одним из основных законов химии является закон сохранения массы веществ (М.Ломоносов, 1741 г.) «Масса веществ, вступивших в реакцию, равна массе веществ, полученных после реакции». Используя этот закон, можно устанавливать количественные соотношения между веществами, участвующими в химических реакциях.
А. Авогадро установил, что в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). Из этого закона вытекают следствия:
I. Одинаковое число молекул различных газов при одинаковых внешних условиях будет занимать одинаковый объем. 1 моль любого газа при нормальных условиях (температура 273 К и давление 101,3 кПа) будет занимать объем 22,4 л. Этот объем называют молярный объем газа (Vо).
n = V/V0
| где: | n | — количество вещества (моль); |
| V | — объем газа (л); | |
| V0 | — молярный объем газа (л/моль). |
II. Относительная плотность одного газа по другому (D) равна отношению молярной массы исследуемого газа к молярной массе газа, с которым проводится сравнение.
D=M1/М2
| где: | D | — плотность одного газа по другому (безразмерная величина); |
| M1 | — молярная масса неизвестного газа (г/моль); | |
| M2 | — молярная масса газа с которым проводят сравнение (г/моль). |
Чтобы было понятно, с каким газом проводят сравнение, ставят индекс DH2 (плотность по водороду, т.е. сравнение проводят с водородом)

| где: | 
| — молярная масса водорода равная 2 г/моль; |
| M(х) | — молярная масса неизвестного газа (г/моль). |
тогда
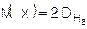
Зная плотность одного газа по другому, можно вычислить молярную массу газа, если химическая формула его неизвестна.
Пример 1. Какой объем займут при н.у. 8 г кислорода?
Молярная масса кислорода (O2) = 32 г/моль. Найдем, сколько молей составляют 8 г кислорода.
n = m/M = 8/32 = 0.25 моль.
Используя следствие из закона Авогадро можно записать V=Vo∙n, подставляем полученное значение и получаем V = 0,25∙22,4 = 5,6 л
Пример 2. Чему равна молярная масса газа и его плотность по воздуху, если 11 грамм его занимают объем 5,6 л (н.у.)?
М(х) = m/ n; n = V/V0 =>


Dвозд. = М(х)/М возд. М возд.= 29 г/моль Dвозд. = 44/29 =1,52
Пример 3. Сколько атомов водорода содержится в 1,7 г аммиака?
Чтобы найти число атомов водорода в молекуле аммиака, нужно сначала найти число молекул аммиака
nмол.= n ∙NA; n = m/M; M(NH3) = 17 г/моль; nмол = 1,7/17∙6,02 1023 = 6,02∙1022. В каждой молекуле аммиака 3 атома водорода, поэтому общее число атомов водорода будет равно
n = 6,02∙1022 ∙ 3 = 1,8∙1023.
Контрольные задачи
Не нашли, что искали? Воспользуйтесь поиском: