
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
САБАҚТЫҢ ХРОНОМЕТРАЖЫНА МЫСАЛ
| Кіріспе бөлім (ұйымдастыру моменті) | 5 мин | |
| Пән саясатын баяндау және талқылау | 5 мин | |
| Техника қауіпсіздігінің ережелерімен таныстыру | 10 мин | |
| Материалды мәселелік баяндау және пікірталас | 20 мин | |
| Лаборияториялық жұмысты теориялық тұрғыдан талқылау | 10 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмысты орындау және талқылау | 25 мин | |
| Жазбаша бақылау | 20 мин | |
| Сабақты қорытындылау | 5 мин |
БАҚЫЛАУ
Бағаланатын құзыреттіліктер:
1) Құқықтыққұзыреттілік
2) Білім.
Бақылау әдістері:
1) Құқықтық компетенцияны бағалау үшін тест тапсырмаларын орындау;
2) Тест тапсырмаларын немесе бақылау карталарын орындау
Бақылау сұрақтары:
1. Термодинамикалық жүйенің параметрлері: негізгі, күй функциялары (ішкі энергия, энтальпия, энтропия, изобаралық-изотермиялық потенциал), экстенсивті, интенсивті.
2. Термохимия. Химиялық реакцияның жылу эффектісі. Термохимиялық теңдеулер. Мысалдар келтіріңіздер. Стандартты түзілу жылуы, стандартты жану жылуы, стандартты бейтараптану жылуы.
3. Химиялық реакция жылдамдығы деген түсінікке анықтама беріңіз. Реакцияның орташа және шынайы жылдамдығы арасындағы айырмашылықты көрсетіңіз. Химиялық реакция жылдамдығы қандай өлшем бірлігімен өлшенеді?
4. Химиялық реакция жылдамдығына әрекеттесуші заттар концентрациясы қалай әсер етеді? Массалар әрекеттесуші заңы. Химиялық реакция жылдамдығының тұрақтысының физикалық мәнін сипаттаңыз.
5. Әрекеттесуші заттар табиғатының химиялық реакция жылдамдығына әсері. Химиялық реакция жылдамдығына катализатордың қатысы қалай әсер етеді? Активтендіру энергиясын қалай түсінесіз?
6. Химиялық реакция жылдамдығына температураның әсері. Вант-Гофф ережесі.
Әдебиет:
Негізгі:
1. Сейтембетов, Т.С. Химия [Мәтін]: Оқулық / Т.С. Сейтембетов.- Алматы: Эверо, 2010.- б.4-31.
2. В.А. Попков, С.А. Пузаков. Жалпыхимия [Мәтін]: Оқулық / ҚазақтілінеаударғанС.Н.Ділмағамбетов. ЖауаптыредакторыЖ.Ж.Ғұмарова.- Москва: ГЭОТАР-МЕДИА, 2014.- б. 150-229.
3. Л.Г. Веренцова ж.б. Бейорганикалық, коллоидты және физикалық химия [Мәтін]: / Л.Г. Веренцова, Е.В., Нечепуренко, А.А. Батырбаева, Э.К. Карлова. - Оқу құрал. - Алматы: Эверо, 2009.- б. 10-47.
Қосымша:
1. ЕсімжанА.Е. Жалпыхимияпрактикум [Мәтін]: Оқулық.- Алматы, 2004.- 296 б.
2. А.С. Қожамжарова и др. Бейораникалық химия практикумы [Мәтін]: Оқу-әдістемелік құрал / КазНМУ им.Асфендиярова.- Алматы: Эверо, 2013.- 280 б.
3. Л.Г. Веренцова, Е.В. ж.б. Бейорганикалық, коллоидтыжәнефизикалықхимия [Мәтін]: Бақылаутестері / Л.Г. Веренцова, Е.В., Нечепуренко, А.А. Батырбаева, Э.К. Карлова. - Алматы: Эверо, 2009.- 212 б.
Дополнительная
1. Б.А. Бірімжанов. Жалпы химия [Мәтін]: Оқулық.-Алматы: Ана тілі, 2001.- 640 б.
Ағылшын тілінде:
1. Morris Hein, Scott Pattison, Susan Arena. Introduction to General, Organic, and Biochemistry [Text]: Book / 10th Edition.-USA: John Wiley&Sons, Inc, 2012.-1091 p.
ОСЫМША
Лабораториялық жұмыс «Бейтараптау жылуын анықтау»
Жұмыстың мақсаты: Күшті қышқылдың бейтараптау жылуын күшті негіз арқылы тәжірибелік жолмен анықтау
Жұмыстың жүргізілуі:
| Реакцияның жылу эффектісін өлшеу үшін бірінің ішіне бірі салынған екі стаканнан тұратын қарапайым калориметрді қолданады. Жылу сыртқа кетпеу үшін екі стаканның арасына жылылықты сақтап тұратын материал (пенопласт) салынды. Сыртқы стакан термометр, былғауыш және құйғышқа арналған арнайы тесігі бар қақпақпен жабылады. Сол тесік арқылы стаканға әрекеттесуші заттар құйылады. Калориметрдің ішкі стаканына бюреткадан 50 мл натрий гидроксидінің эквивалентінің молярлық концентрациясы 1 моль/л-ге тең (0,05 моль NaOH) ерітіндісін құяды. Екінші бір стаканға 50 мл тұз қышқылының эквивалентінің молярлық концентрациясы 1 моль/л-ге тең (0,05 моль НС1) ерітіндісін құяды. Қышқылдың ТҚ және сілтінің ТС температурасын анықтайды, сонан соң құйғыш арқылы қышқыл ерітіндісін сілті ерітіндісіне жылдам құяды. Ерітіндіні былғауышпен араластыра отырып, оның ең жоғарғы температурасын өлшейді Т2. Алынған мәліметтерді кестеге жазады. | |||||
| Өлшенген және есептелген мәндер | Әрекеттесуші заттар | |||||
| HCl + NaOH | HNO3 + KOH | |||||
| HCl | NaOH | HNO3 | KOH | |||
| Ерітінділер концентрациясы С, моль/л | ||||||
| Ерітінділер көлемі V, л | ||||||
| Зат мөлшері n, моль n = C.V | ||||||
| Ерітінді температурасы (ТҚ және ТС) | ||||||
| Бастапқы өлшеулердің орташа температурасы (Т1) T1 = (ТҚ + ТС)/2 | ||||||
| Бейтараптанғаннан кейінгі ең жоғарғы температура (Т2) | ||||||
| Температуралар айырымы ΔТ ΔТ = Т2 – Т1 | ||||||
Калориметрлік стакандағы ерітінді массасын келесі формула бойынша анықтайды:  , мұндағыVер-ді – бейтараптанғаннан кейінгі ерітінді көлемі (VС + VҚ), мл; сұйылтылған ерітінді тығыздығы 1 г/мл-ге тең деп алынады.Бейтараптау реакциясының түзілу жылуын келесі формула бойынша есептейді:
, мұндағыVер-ді – бейтараптанғаннан кейінгі ерітінді көлемі (VС + VҚ), мл; сұйылтылған ерітінді тығыздығы 1 г/мл-ге тең деп алынады.Бейтараптау реакциясының түзілу жылуын келесі формула бойынша есептейді:  , Дж
, Дж
Сонымен, Q1 – бұл реакция барысында түзілген жылу мөлшері.
Бейтараптау реакциясының меншікті жылуын есептеу үшін реакция барысында түзілген жылу мөлшерін әрекеттесуші қышқыл немесе сілтінің 1 молі үшін қайта есептеу керек, өйткені ол түзілген судың 1 моліне сәйкес келеді:  , Дж/моль.
, Дж/моль.
Түзілген бейтараптау жылуын теория жүзіндегі мәнімен салыстырып, тәжірибенің абсолюттік және меншікті қатесін есептеңіз. Қатенің себептерін түсіндіріңіз.
Қорытынды: Бейтараптау реакциясының түзілу жылуын анықтаңыз, тәжірибенің абсолюттік және меншікті қатесін есептеңіз.
Лабораториялық жұмыс «Реакция жылдамдығының әр түрлі факторларға тәуелділігін зерттеу»
1-ші тәжірибе.«Реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігі»
Жұмыстың мақсаты: Реакция жылдамдығының әрекеттесуші заттардың концентрациясына тәуелділігін натрий тиосульфаты мен күкірт қышқылының арасындағы реакция арқылы зерттеу.
Na2S2O3 + H2SO4 = S↓ + Na2SO4 + H2O
Жұмыстың жүргізілуі: Нөмірленген үш пробиркаға натрий тиосульфатының 1М ерітіндісін құяды: біріншісіне – 7 тамшы, екіншісіне – 14 тамшы, үшіншісіне – 21 тамшы. Бірінші пробиркаға 14 тамшы су, ал екінші пробиркаға 7 тамшы су тамызады. Басқа үш пробиркаға 7 тамшыдан күкірт қышқылын тамызады.
Реакция жылдамдығын анықтау үшін натрий тиосульфаты мен қышқыл құйғаннан бастап ақ түсті лай пайда болғанға дейінгі уақытты (күкірттің пайда болу белгісі) секундомердің көмегімен анықтайды. Натрий тиосульфаты құйылған басқа пробиркаларға да алдын-ала дайындалған (7 тамшы) күкірт қышқылының ерітіндісін құйып, ақ түсті лай пайда болғанға дейінгі уақытты анықтайды. Алынған мәліметтерді кестеге жазады. :
| Пробирка № | Ерітінді көлемі (тамшылар) | Ерітіндінің жалпы көлемі (тамшы) | Натрий тиосульфатының меншікті концентрациясы(C) | Ақ түсті лайдың пайда болу уақыты t, с | Реакцияның меншікті жылдамдығы w=1/t (с-1) | ||
| Na2S2O3 | H2O | H2SO4 | |||||
| - |
Реакцияның меншікті жылдамдығын уақытқа кері шама ретінде анықтайды. (w=1/t). Тәжірибе нәтижесінде реакция меншікті жылдамдығының натрий тиосульфатының меншікті концентрациясына тәуелділік графигін тұрғызады (абцисса осінде концентрация, ордината осінде – реакция жылдамдығы).
Қорытынды: Әрекеттесуші заттар концентрациясының реакция жылдамдығына тәуелділігін сипаттаңыз. Натрий тиосульфаты бойынша реакцияның ретін анықтаңыз
2-ші тәжірибе.«Химиялық реакция жылдамдығының температураға тәуелділігі»
Жұмыстың мақсаты: Химиялық реакция жылдамдығының температураға тәуелділігін зерттеу.
Зерттелетін реакция:
Na2S2O3 + H2SO4 = S↓ + Na2SO4 + H2O
Жұмыстың жүргізілуі: Нөмірленген үш пробиркаға натрий тиосульфатының 1М ерітіндісін 10 тамшыдан құяды. Басқа үш пробиркаға 10 тамшыдан күкірт қышқылының 1М ерітіндісін құяды.
Бірінші жұп пробиркаларды (күкірт қышқылы – натрий тиосульфаты) және термометрді бөлме температурасындағы су құйылған стаканға салып, 5 минуттан соң пробиркалардағы температура теңескенде термометр көрсеткіштерін жазады. Пробиркаларды бір-біріне құйып араластырады да, құйғаннан бастап лай пайда болғанға дейінгі уақытты санайды.
Пробиркалардың екінші жұбын бөлме температурасынан 10 градусқа, ал үшінші жұбын 20 градусқа жоғары су құйылған стаканға 5 минутқа салады. Температура теңескеннен кейін пробиркалардағы ерітінділерді бір-біріне құйып араластырады да, бірінші тәжірибедегі сияқты құйғаннан бастап лай пайда болғанға дейінгі уақытты санайды. Алынған мәліметтерді кестеге жазады:
| Пробирка № | Ерітінді көлемі (тамшылар) | Температура, оС | Ақ түсті лайдың пайда болу уақыты, t, с | Реакцияның меншікті жылдамдығы w=1/t (с-1) | |
| Na2S2O3 | H2SO4 | ||||
Тәжірибе нәтижесінде реакция меншікті жылдамдығының температураға тәуелділік графигін тұрғызады (абцисса осінде температура, ордината осінде – реакция жылдамдығы).
Вант-Гофф теңдеуі бойынша температуралық коэффициенттің орта мәнін есептеңіз. ΔТ = 10-ға тең болғандықтан температуралық коэффициентті жылдамдықтардың қатынасы бойынша анықтайды:
 ;
;  ;
; 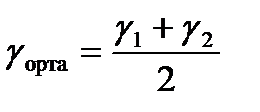
Қорытынды: Берілген реакция үшін температуралық коэффициенттің мәнін есептеңіз және реакция жылдамдығының температураға тәуелділігін сипаттаңыз.
№2 тәжірибелік сабақ
ТАҚЫРЫБЫ: Ерітінділер: құрамын өрнектеу тәсілдері және коллигативтік қасиеттері. Концентрлі ерітіндіден сұйылтылған ерітінді дайындау
МАҚСАТТАРЫ:
· ерітінділер теориясының негізгі түсініктері жайлы және табиғаттағы ерітінділердің биологиялық рөлі жайлы түсініктерін кеңейту;
· ерітінділер құрамын өрнектеу тәсілдері жайлы түсінік қалыптастыру;
· биологиялық нысандарды талдау үшін қажет болатын түрлі концентрациядағы ерітінділерді дайындауға қажет есептеулерді үйрету;
· ерітінділердің медициналық тәжірибеде қолданылуын көрнекілікті қарастыру арқылы студенттерде химияны зерттеу мотивациясын дамыта білу;
· Ақпаратпен өздігінен жұмыс істей білу дағдыларын дамыту.
ОҚЫТУ МІНДЕТТЕРІ:
· түрлі концентрациядағы ерітінділерді дайындау және ерітінді құрамын өрнектеудің бір тәсілінен екінші бір тәсіліне өту үшін қажет есептеулерді үйрету;
· есептеу үшін қажетті мәндерді табу үшін анықтамалық әдебиеттерді дұрыс қолдана білуді дағдыландыру;
· концентрлі ерітіндіден сұйылтылған ерітінді дайындау дағдыларын қалыптастыру;
· белгілі массасы бойынша ерітінді дайындауға және оның концентрациясын тәжірибелік жолмен таба білуге үйрету;
· орындалған лабораториялық жұмыстың нәтижелерін талдай білуге үйрету.
ТАҚЫРЫПТЫҢ НЕГІЗГІ СҰРАҚТАРЫ:
1. Ерітінділер теориясының негізгі түсініктері.
2. Ерітінділердің тірі ағза үшін маңызы.
3. Способы выражения состава растворов
4. Ерітінділердің медициналық тәжірибеде қолданылуы.
ОҚЫТУ әдістері:
Үйлескен түрде:
- материалды мәселелік түрде баяндау (студенттерде гипотезаларды ұсыну, алдын-ала қорытындылар және ойларын түйіндей білуді дамыту);
- кіші топтарда жұмыс жасау (лабораториялық жұмысты орындау)
Не нашли, что искали? Воспользуйтесь поиском: