
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПРАКТИЧЕСКАЯ ЧАСТЬ РАБОТЫ. Цель занятия – научить студентов использовать информацию, заложенную в двойных диаграммах состояния металлических сплавов для решения практических задач
ЦЕЛЬ ЗАНЯТИЯ
Цель занятия – научить студентов использовать информацию, заложенную в двойных диаграммах состояния металлических сплавов для решения практических задач применительно к реальным промышленным системам сплавов.
СОДЕРЖАНИЕ ЗАНЯТИЯ
Занятие следует проводить после прочтения в лекциях разделов об основных типах диаграмм состояния двойных металлических систем. Задания по разбору диаграмм состояния и решению задач выполняются в виде самостоятельной работы студентов.
В начале занятия необходимо напомнить студентам, что диаграммы состояния показывают в условиях термодинамического равновесия фазовый состав сплавов в зависимости от температуры и концентрации и позволяет качественно характеризовать многие физико-химические, физические, механические и технологические свойства сплавов.
Важно подчеркнуть, что анализ диаграмм состояния позволяет решать важные инженерные задачи. Например, определить для любого сплава, в каком направлении он изменяет свою структуру и свойства при переходе к неравновесному состоянию, зависящему от реальных условий литья, обработки давлением и термической обработки.
Представляется целесообразным выдавать студенту одну задачу по анализу диаграмм состояния. Сначала он должен вычертить диаграмму и схематически построить кривые охлаждения для тех сплавов, которые указаны в задаче. Далее надо определить изменение фазового состава и числа степеней свободы сплавов в процессе охлаждения и дать схематическое изображение микроструктуры после окончательного затвердевания. В дополнении к этому, исходя из правила отрезков, следует определить относительное количество отдельных фаз, присутствующих в сплаве в состоянии равновесия. Соответствующие диаграммы состояния даны ниже.
От студентов требуется, чтобы они сразу записывали содержание своей задачи.
ОСНОВНЫЕ СВЕДЕНИЯ
Диаграмма состояния характеризует изменение фазового состояния сплавов в зависимости от их состава и температуры. В ней обобщены данные по температурам плавлениям, кристаллизации и другим фазовым превращениям в различных сплавах данной системы. По диаграмме состояния можно судить о различных фазовых превращениях, протекающих в сплавах при изменении температуры и состава, и тем самым установить условия соответствующей обработке сплава (литья, термической обработки, горячей пластической деформации).
Диаграмма состояния строится по критическим точкам серии сплавов, определяемых методами физико-химического анализа. Критическими точками называются температуры начала или конца каких-либо превращений в сплавах.
Любая точка на диаграмме имеет определённый физико-химический смысл. Линии, соединяющие одноименные критические точки, носят определённые названия. Так линия аЕ (рис. 1), представляющая собой совокупность точек начала кристаллизации, носит название линии ликвидуса (liquidus – жидкий). Выше этой линии все сплавы данной системы находятся в жидком состоянии. Линия ав (рис. 1), ниже которой все сплавы находятся в твёрдом состоянии, называется линией солидуса (solidus – твёрдый).
Для анализа диаграмм состояния широко применяется правило фаз Гиббса, выражающее условия равновесия системы. Количественная зависимость между числом степеней свободы системы С, число компонентов К и фаз Ф записывается в виде: С=К+2-Ф. Фазой называется физически и химически однородная часть сплава, ограниченная поверхностью раздела. Она может состоять из одного или нескольких компонентов (самостоятельных веществ), необходимых и достаточных для образования всех фаз сплава. Числом степеней свободы системы (вариантностью) называется число параметров состояния (температура, давление и концентрация), которое можно изменять без нарушения фазового равновесия (без изменения числа или природы сосуществующих фаз). Число степеней свободы может быть только положительной величиной или при нонвариантном равновесии равно нулю. Таким образом, для каждого сплава (систем фаз) можно произвольно задавать лишь определённое число характеризующихся его параметров, а все остальные будут их функциями.

Рисунок 1. Диаграмма состояния системы алюминий – медь
В случае достижения системой состояния термодинамического равновесия температура и давление во всех фазах имеют одно и то же значение. При этом химические потенциалы каждого компонента во всех фазах должны быть равны и не должно происходить переходов компонента из одной фазы в другую. Цифра 2 в уравнении показывает, что в общем случае на состояние фазового равновесия влияют только два внешних фактора: температура и давление. Однако на практике давление изменяется в таких небольших пределах, что это не влияет на характер фазовых превращений в сплавах. Необходимы очень высокие давления, чтобы изменить характер процессов и превращений в сплавах. Кроме того, в большинстве металлических систем давление пара настолько мало, что им пренебрегают и считают системы конденсированными. В связи с этим для металлических систем при атмосферном давлении один из внешних факторов равновесия будет постоянным, и тогда правило фаз примет вид: С=К+1-Ф.
В этом уравнении единица соответствует единственному внешнему фактору (температуре), который способен изменить фазовое равновесие. Применяя правило фаз, например, для процессов кристаллизации или плавления чистого металла в изобарических условиях (в равновесии находятся две фазы: жидкая и твёрдая), получаем C=K+1-Ф=1+1-2=0, то есть система безвариантна. Это означает, что указанные процессы идут при постоянной температуре, что находит своё отражение, например, на кривых охлаждения чистых металлов, где горизонтальные участки соответствуют процессам кристаллизации при постоянной температуре. В отличие от этого при кристаллизации твёрдой фазы из жидкости в двухкомпонентной системе C=1, то есть равновесие одновариантно, и процесс идёт при переменной температуре. Процессу кристаллизации в данном случае будет соответствовать выпуклый участок кривых охлаждения.
ПРАКТИЧЕСКАЯ ЧАСТЬ РАБОТЫ
ЗАДАЧИ
Задача 1. На рисунке 1 изображена диаграмма состояния системы алюминий – медь.
Вопрос 1. Указать физико-химический смысл важнейших точек диаграммы.
Вопрос 2. Определить по диаграмме следующие линии: а – линию ликвидуса; б – линию солидуса; в - эвтектическую линию; г – линию сольвуса (линию предельной растворимости меди в твёрдом растворе на основе алюминия).
Вопрос 3. Построить кривую охлаждения сплава с 4% меди с указанием процессов, происходящих при охлаждении этого сплава. Определить по правилу фаз вариантность системы в каждом процессе. Дать схематическое изображение окончательной микроструктуры сплава.
Задача 2. Дана диаграмма состояния алюминий медь (рис. 1).
Вопрос 1. Указать строение (фазовый состав и структурные составляющие) сплава с 12% меди при температурах: 660º, 560º и 20ºС.
Вопрос 2. Какое число степеней свободы сплава с 12% меди будет при температурах: 660º, 560º и 20ºС?
Вопрос 3. Указать, какие отклонения в структуре при первичной кристаллизации сплава с 4% меди можно ожидать в условиях ускоренного охлаждения.
Задача 3. Пользуясь диаграммой состояния алюминий – медь (рис. 1).
Вопрос 1. Изобразить кривую охлаждения сплава, содержащего 20% меди. Указать изменение фазового состава сплава и числа степеней свободы в процессе охлаждения и дать схематически его конечную микроструктуру.
Вопрос 2. Каков состав жидкой фазы сплава с 20% меди, которая кристаллизуется при 548ºС?
Вопрос 3. Определить количественное соотношение жидкой и твёрдой фаз сплава с 20% меди при 548ºС?
Задача 4. На рисунке 2 приведена диаграмма состояния системы магний – алюминий.
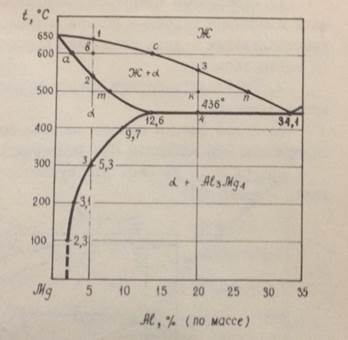
Рисунок 2. Диаграмма состояния системы магний – алюминий
Вопрос 1. Построить кривую охлаждения сплава, содержащего 5% алюминия, с указанием процессов, происходящих при охлаждении этого сплава. Определить число степеней свободы в каждом процессе и дать схему конечной микроструктуры этого сплава.
Вопрос 2. Определить фазовый состав и количественное соотношение фаз сплава с 5% алюминия при 600ºС.
Вопрос 3. Имеется сплав с 5% алюминия. При охлаждении из расплавленного состояния возможно быстрое и медленное прохождение интервала кристаллизации. Указать разницу в строении полученного сплава.
Задача 5. Дана диаграмма состояния системы магний – алюминий (рис. 2).
Вопрос 1. Построить кривую охлаждения и разобрать процессы фазовых превращений у сплава с 20% алюминия, определить вариантность превращений и нарисовать схему окончательной микроструктуры этого сплава.
Вопрос 2. Как определить количество алюминия в твёрдой и жидкой фазах при температуре 500ºС в сплаве с 20% алюминия (рис. 2)?
Вопрос 3. По кривой сольвуса на диаграмме состояния (рис. 2) определить изменение растворимости алюминия в твёрдом растворе на основе магния при уменьшении температуры с 436º до 100ºС.
Задача 6. Исходя из диаграммы состояния магний – алюминий (рис. 2).
Вопрос 1. Изобразить кривую охлаждения сплава с 34,1% алюминия. Указать изменение строения сплава и число степеней свободы в процессе кристаллизации и дать схему его микроструктуры после окончательного затвердевания.
Вопрос 2. Определить состав твёрдого раствора α при эвтектической кристаллизации.
Вопрос 3. Какие фазы и какого состава могут существовать в сплаве, содержащем 20% алюминия при температуре 500ºС?
Задача 7. На рисунке 3 приведена диаграмма состояния системы титан – алюминий.
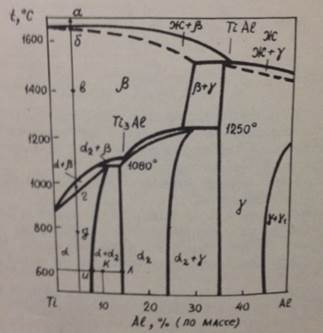
Рисунок 3. Диаграмма состояния системы титан – алюминий
Вопрос 1. Дать схемы строения сплава, содержащего 10% алюминия, в точках а, б, в, г и д. Определить вариантность системы в указанных точках.
Вопрос 2. Какой тип превращения наблюдается в сплаве с 10% алюминия при медленном охлаждении с температуры 1200º до 900ºС? Найти правильный ответ из предложенных: 1 – эвтектическое, 2 – эвтектоидное, 3 – перитектическое, 4 – полиморфное.
Вопрос 3. Определить фазовый состав и количественное соотношение фаз сплава с 30% алюминия при 600ºС.
Задача 8. На рисунке 4 дана диаграмма состояния системы железо – углерод (цементит).
Вопрос 1. Указать физико-химический смысл важнейших точек диаграммы: A, B, C, D, E, F, G, S, P, Q, K.
Вопрос 2. Определить по диаграмме следующие линии: а – линию ликвидуса, б – линию солидуса, в – эвтектическую линию, г – эвтектоидную линию (А1), д – линию предельной растворимости цементита в аустените, е – линию предельной растворимости цементита в феррите, ж – линию выделения α-феррита из аустенита (А3).
Вопрос 3. Построить кривую охлаждения эвтектоидной стали (с 0,8% углерода) с указанием изменения фазового состава стали и числа степеней свободы и дать условное изображение её окончательной микроструктуры.
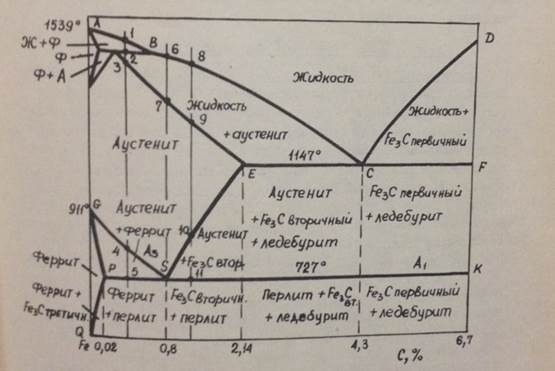
Рисунок 4. Диаграмма состояния системы железо – углерод
Задача 9. Построить кривую охлаждения стали с 0,4% углерода (стали 40) с указанием вариантности процессов, происходящих при охлаждении этой стали. Дать условное изображение её микроструктуры.
Задача 10. Построить кривую охлаждения стали с 1,2% углерода (стали У12). Указать изменение фазового состава и числа степеней свободы при её охлаждении и дать условное изображение её окончательной микроструктуры.
Не нашли, что искали? Воспользуйтесь поиском: