
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Правила и принципы заполнения АО электронами
1. Принцип минимальной энергии – в основном состоянии первыми заполняются орбитали с наименьшей энергией, соответствующие наиболее устойчивому состоянию. АО с min энергией – это 1s.
Последовательность заполнения энергетических уровней:
n=1 → n=2 → n=3 → n=4 и т.д.
2. Правило В. Клечковского - увеличение энергии орбиталей происходит в порядке возрастания суммы (n + l), а при равной сумме (n + l) - в порядке возрастания n:
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈5d≈4f<6p<7s≈6d≈5f<7p
Для 4s-АО сумма (n+l)=4+0=4. Для 4-АО сумма (n+l)=4+1=5. Для 3d-АО сумма (n+l) =3+2=5. Поэтому сначала заполняется электронами 4s-АО (19K, 20Ca), затем 3d-АО (от 21Sc до 30Zn) и потом 4р-АО (31Ga, 32Ge…..).
3. Принцип запрета Паули - в атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел n, l, ml, ms. Следовательно, на каждой орбитали может быть не более двух электронов, причем они должны иметь противоположные спины (↑↑ или ↓↓ - невозможно).
| ↑↓ |
4. Правило Гунда – электроны, имеющие одинаковое значение l, но разное m l занимают АО так, чтобы сумма спиновых чисел была максимальной (знак не имеет значения).
р 4
| ↑↓ | ↑ | ↑ |
Max ∑ ms = ½ - ½ + ½ + ½ = 1
Электронная конфигурация атома - запись распределения электронов в атоме по уровням и подуровням. Формирующий электрон – ē, который последним заполняет орбитали атома и.
15Р 1s2 2s2 2p6 3s2 3p3 - полная электронная формула.
Р … 3s2 3p3 3s 3p
| ↓↑ | ↓ | ↓ | ↓ |
краткая электронная конфигурация.
Формирующий электрон 3p3: n=3, l =1; m l = -1,0,+1 (одно из трех значений), ms=+½ или -½.
Валентные электроны составляют краткую электронную конфигурацию атома
В ПСЭ различают 4 группы элементов, называемых по формирующему электрону s-, p-, d-, f- элементы.
Краткая электронная конфигурация:
· для s-элементов (подгруппы IА, IIА, Н и Не) ns1-2, n- номер периода
пример: 19К …4s1
· для p- элементов (IIIА–VIIIА) ns2np1-6,
пример: 4B …2s22p1
· для d-элементов (IБ–VIIIБ) (n-1)d1-10ns2(1,0 )
где (n-1) – предвнешний энергетический уровень,
пример: 21Sc …3d14s2
(– у Pd; ns1,0 –«провал» ns- электронов на (n-1)d-подуровень, это связано с более низкой энергией конфигурации (n-1)d10 и (n-1)d5по сравнению с d9 и d4)
· для f-элементов (лантанидов и актинидов) (n-2)f1-14(n-1)d1(0)ns2
где (n-2) – предпредвнешний энергетический уровень (d0 –«провал» d-электрона)
пример: 64Gd …4 f7 5d1 6 s2
Валентность - способность атома образовывать определенное число химических связей. Валентность по обменному механизму равна числу внешних неспаренных электронов в атоме. Различают валентность в основном (В) и возбужденном (В*) состоянии атома.
Кислород, азот и фтор – возбужденного состояния нет (нет 2d-подуровня).
Распаривание электронов возможно только в пределах одного энергетического уровня.
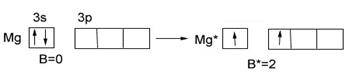
У магния Mg…3s2 в основном состоянии нет неспаренных электронов (В=0), при переходе в возбужденное состояние и распаривании 3s-ē В*=2.
Хлор Cl…3s23p5 (аналог фтора) – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободных d -орбиталей на третьем энергетическом уровне
 |
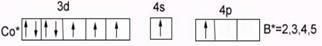
У кобальта Cо…3d74s2 В0= 0 – нет внешних неспаренных электронов в основном состоянии. В возбужденном состоянии В*=2,3,4,5, распаривания 3d парных ē невозможно из-за отсутствия на n=3 f-подуровня.


Не нашли, что искали? Воспользуйтесь поиском: