
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Понятия обратимых и необратимых процессов 9 страница
Однако вследствие того, что покровное стекло плотно не прикрывает верхнее основание рабочей ячейки камеры, часто нарушается осмотический кругооборот жидкости. Более приемлема конструкция такой рабочей ячейки, которая бы легко заполнялась и промывалась, с сохранением всех основных параметров расчета, применяемых для плоских камер. Должна быть создана такая конструкция пробки, которая должна соответствовать нормативам, вытекающим из расчета, применяемого для плоских камер.
При создании камеры необходимо остановиться на выборе неполяризующихся электродов из агар-агарового мостика. В отличие от систем, используемых для таких электродов, желательно применить устойчивую конструкцию, например, состоящую из щечек, плотно приклеенных (дихлорэтаном) к боковым основаниям камеры. В отверстия, соединенные в нижнем и верхнем основании их, можно помещать агар-агар, разбавленный 3%-ым КСl и серной кислотой. Через серную кислоту происходит соединение посредством хлорсеребряных электродов рабочей ячейки камеры с блоком питания установки. Агар-агар заполняет продольное отверстие камеры, соединенное с рабочей ячейкой. В рабочей ячейке сделаны параллельные пазы (вырезы) на расстоянии 1 см друг от друга, которые также заполняются агар-агаром. Агар-агар, находящийся в параллельных пазах, непосредственно контактирует с исследуемым объектом.
Заполнение агар-агаром параллельных пазов рабочей ячейки создает в ней однородное электрическое поле, в отличие от стеклянных трубочек с вытянутыми кольцами и заполненными агар-агаром, которые используются в обычной методике, описанной выше. Следует особое внимание обратить на приготовление агар-агара при использовании его в системе неполяризующихся электродов. Опыты показывают, что нужно в 50 г раствора добавлять 25 капель КС1.
Измеренное сопротивление агар-агаровых столбиков в среднем равняется от 2 до 4 Ом. Заправленной камеры достаточно на длительный срок работы. Знать сопротивление электродов необходимо для точного расчета градиента напряженности, вычисление которого способствует точному определению истинного значения электрофоретической подвижности, по формуле
 (5.31)
(5.31)
где (j1-j2) - падение напряжения на электродах, В.
В процессе работы по показанию миллиамперметра находят величину тока, протекающего через электроды, и рабочую ячейку камеры. Следует учесть, что величина сопротивления очень (при значительном разведении) мала.
Раствор центрифугируется в течение 35 минут при 1200 об/мин. Сыворотка крови, имеющая малое количество эритроцитов, лейкоцитов, является хорошим проводником и обладает малым сопротивлением. Зная величину тока и определив, при помощи моста Уинстона, сопротивление электродов, можно найти падение напряжения (j1-j2).
Разность показания вольтметра и падение напряжения на электродах дает истинное значение напряжения в рабочей ячейке камеры. Если добиться, чтобы градиент потенциала в рабочей ячейке камеры был примерно равен 100 в/м, то это упрощает расчет при нахождении истинного значения ЭФП форменных элементов крови.
Исследования показывают, что особое внимание следует обращать на изменения температуры. При нагревании исследуемого объекта только на 1 °С наблюдаются изменения в показаниях ЭФП форменных элементов крови, которые связаны с усилением хаотического движения клеток, имеющих малые размеры. Тарусов Б.И. (1970) считал, что для исключения теплового эффекта необходимо использовать систему плоских кювет, наполненных водой, через которые должен проходить луч, освещающий камеру. Однако устойчивая работа этой системы достигается только при использовании не менее трех кювет, но и в этом случае отмечается уменьшение светового потока, освещающего рабочую ячейку камеры, что сопровождается плохой видимостью клеток, особенно при работе с фазовоконтрастной приставкой. Также следует отметить громоздкость и неустойчивость всей системы, плохую фокусировку при её использовании.
Для исключения теплового эффекта и для подсветки рабочей ячейки камеры следует использовать световод и систему водяного охлаждения всей камеры с применением ультратермостата. Световод очень удобен в работе при использовании в качестве подсветки, а освещенности вполне достаточно для хорошей видимости форменных элементов крови в исследуемом объекте. При помощи световода хорошо производится фокусировка всей оптической системы, так как, убрав зеркало, можно укрепить его строго по центру, что очень важно при использовании фазово-контрастной приставки типа ФК-1. Нарушение центровки при использовании фазового контраста, как правило, ведет к неправильному освещению белого и черного кругов и, подчас, невозможности добиться четкого и полного обозначения белого круга. Неправильная настройка фазового контраста в итоге приводит к потере видимости тромбоцитов.
В качестве источника тока многие авторы рекомендуют для микроэлектрофореза использовать сухие элементы (БАС-80 или БАС-60) или аккумулятор. При питании камеры от сети переменного тока лучше всего использовать выпрямитель с п-образным фильтром.
5.3. Мембранные потенциалы. Потенциал покоя и действия. Их регистрация
Мембранные потенциалы можно считать частным видом диффузионного потенциала. Предположим, что мембрана является полупроницаемой, то есть пропускает только катионы. Подвижность аниона равно нулю (V=0). В этом случае возникает разность потенциалов, которую можно определить по формуле Нерста.
Действительно, выражение принимает вид:
 , (5.32)
, (5.32)
то есть мембранный потенциал зависит от величины концентрационного градиента и температуры.
Перейдя от натуральных логарифмов к десятичным и подставив значения R и F, при Т = 20 0С получим:
 (5.33)
(5.33)
Из уравнения (5.33) видим, что при изменении активности ионов в 10 раз потенциал изменится на 58 мВ.
В соответствии с современными представлениями, потенциалы покоя, повреждения и действия являются по своей природе мембранными потенциалами.
Потенциал покоя. Как показывают эксперименты, проводимые с помощью стеклянного микроэлектрода, вводимого непосредственно в цитоплазму клетки (второй электрод при этом должен находиться во внеклеточной жидкости), цитоплазма в состоянии покоя клетки всегда имеет отрицательный потенциал по отношению к потенциалу межклеточной жидкости. Наблюдается неравномерное распределение ионов калия и натрия между содержимым клеток и окружающей средой.
Доказано, что концентрация ионов калия внутри клеток в 20-40 раз превышает их содержание в окружающей клетку жидкости. Напротив, концентрация натрия в межклеточной жидкости в 10-20 раз выше, чем внутри клеток, таким образом, возникает концентрационный градиент, который и обусловливает наличие у клеток потенциала покоя. Можно считать, что разность потенциалов, измеренная в состоянии физиологического покоя клетки, и будет называться потенциалом покоя, который можно считать частным случаем мембранного потенциала.
Если принять, что потенциал покоя определяется диффузией ионов калия из цитоплазмы наружу, то его величину можно рассчитать по уравнению Нерста:
 , (5.38)
, (5.38)
где Ki – активность ионов калия внутри клетки,
Ке – активность ионов калия снаружи клетки.
Расчеты показывают, что величина потенциала покоя составляет 50-90 мВ. Показано, что мембрана в состоянии покоя проницаема не только для ионов калия, но и в небольшой степени для ионов натрия и хлора.
Для более точного определения потенциала покоя применяют уравнение Ходжкина-Катца-Хасли:
 , (5.35)
, (5.35)
где P - проницаемость клеточных мембран; индекс i показывает внутри клетки, е – снаружи.
Потенциал действия. Нервы и мышцы организма так же способны генерировать ЭДС – биопотенциалы. Их электрическая активность происходит в форме коротких электрических разрядов, каждый из которых длится около одной микросекунды.
Электрический сигнал, отвечающий отдельному импульсу, который распространяется вдоль нервного волокна – аксона, называется потенциалом действия.
Аксоны – это длинные отростки центрально расположенных клеток, служащие коммуникациями, по которым происходят сообщения от органов чувств, направляемые в центральную нервную систему, а также от центральной нервной системе к мышцам.

Рис. 5.3. Строение аксона
На рис. 5.3 представлен аксон (а). Он имеет миелиновую оболочку (Ма).
Миелин представляет собой многослойную мембрану, которая отделяет аксон от окружающей среды.
Перехват Ранвье – (nP). В области перехвата Ранвье мембрана контактирует с окружающей средой.
Ядро – (Я). ОДН – окончание двигательного нерва. МВ – мышечное волокно. Клетка получает сообщение от многих других нейронов через их тонкие ответвления, которые образуют контакты-синапсы с телом и его короткими отростками-дендритами. Получив сообщение, аксон передает импульс на расстояние нескольких метров без затухания и искажения.
В аксоне проводящим веществом является аксоплазма, то есть раствор электролита, удельное сопротивление которого (r) в миллион раз больше, чем у меди и алюминия, из которых изготавливают электрические кабеля.
Расчеты показывают, что мембрана аксона имеет сопротивление около 1000 Ом·см2, емкость мкФ/см2, удельным сопротивлением 2·109 Ом·см показано, что время генерации импульса проводимости мембраны увеличивается примерно в 103 раз.
Прямые опыты с мечеными атомами показывают, что проведение импульса по аксону связано с возрастанием скорости движения натрия и калия по градиентам концентраций. При каждом импульсе наблюдается входящий поток натрия (Na+) равный 10,3·10–12 моль/см2. Учитывая вход Na+ (3,7·10–12 моль/см2) за один импульс он примерно равен выходу (К+).
При генерации импульса в нерве происходят тепловые явления – сначала он нагревается, потом охлаждается.
В биофизике нерва большую роль сыграли работы, которые проводились на изолированных аксонах. В аксон вводят два микроэлектрода. Первый служит для электрической стимуляции возбуждения, а второй – для измерения генерирующего потенциала. Предварительно производят перфузию, то есть выдавливание аксоплазмы из волокна и производят ее замену искусственным раствором.
Опыты показывают, что:
в состоянии покоя клеточной мембраны в результате активного транспорта ионов концентрации ионов К+ в цитоплазме (аксоплазме) значительно превосходят концентрации во внешней среде;
для ионов Na+ ситуация наблюдается совершенно противоположная.
При наложении на мембрану стимулирующего потенциала наблюдается увеличение проницаемости для ионов Na+. Ионы натрия входят в аксон, в результате чего внутренняя поверхность мембраны изменяет знак своего заряда с отрицательного на положительный, таким образом происходит деполяризация мембраны. При деполяризации мембраны возникают токи, которые замыкаются на наружную проводящую среду. Эти токи возбуждают определенный участок аксона, таким образом, происходит генерация импульса (рис 5.4), во время которого закрывается натриевый канал и открывается канал калиевый; ионы выходят наружу, что приводит к восстановлению отрицательного заряда.
Таким образом, между возбужденными и невозбужденными участками аксона возникают потенциалы действия. Они образуют разность потенциалов, под действием которой в аксоплазме возникает электрический ток, который вновь вызывает возбуждение соседнего участка мембраны и появление в нем потенциала действия.

Рис 5.4. Потенциал действия: PNа – импульс вследствие деполяризации мембраны; PK+ - импульс вследствие проницаемости К+ и реполяризации клетки; Е – потенциал действия
Потенциал действия в местах возбуждения будет равен
 ; (5.36)
; (5.36)
 , (5.37)
, (5.37)
где: d – диаметр волокна, м;
R – поверхностные сопротивления, Ом;
r - удельное сопротивление аксоплазмы.
Из формул (5.36) и (5.37) видно, что чем больше k, тем меньше затухает сигнал и тем больше скорость проведения импульса. Если R и r принять за потенциальные величины, то увеличение k можно добиться путем увеличения диаметра аксона. Этим объясняется тот факт, что у кальмаров аксоны достигают больших размеров (до 0,5 мм), что обеспечивает им быстрое проведение нервного импульса и, следовательно, быстроту реакции на внешнее раздражение. Таким образом, проведенные эксперименты без перегрузки показали, что распространение потенциала действия обусловлено возникновением так называемых локальных токов или токов действия, которые циркулируют между возбужденными и невозбужденными участками клетки.
Доказано, что на поверхности клетки локальный ток течет от невозбужденного к возбужденному. Внутри клетки он течет в обратном направлении. Причем локальный ток, как любой другой электрический ток, оказывает раздражающее действие на соседние невозбужденные участки и вызывает увеличение проницаемости их мембран. Под влиянием локальных токов волна возбуждения распространятся вдоль волокна без затухания.
Скорость распространения потенциала действия определяется временем, которое необходимо для критической деполяризации мембраны до ее потенциала.
 (5.38)
(5.38)
Заряд мембраны и ее потенциал изменяются вследствие протекания локального тока. если
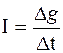 , (5.39)
, (5.39)
то
 . (5.40)
. (5.40)
Используя закон Ома, получим
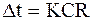 . (5.41)
. (5.41)
Таким образом, время поляризации и время проведения возбуждения пропорциональны CR. Данная величина называется постоянной временем мембраны.
Сопротивление R является суммой сопротивлений всех последовательных участков, по которым протекает локальный ток мембраны (цитоплазмы, межклеточной жидкости и т.д.)
Скорость проведения импульса возрастает с увеличение диаметра волокна, таким образом, уменьшается сопротивление на единицу его длины.
Опыты с перфузией и без перфузии показали, что:
величина токов действия не зависит от величины стимулирующего тока;
потенциал действия не возникает, если электрический стимул не достигает некоторого порогового значения.
На рис. 5.5 показана кривая зависимости порогового тока Iп от длительности импульса Δt, имеющая форму гиперболы.

Рис. 5.5. Зависимость порогового тока от времени
Обычно её описывают эмпирической формулой (формула Лапика):
 , (5.42)
, (5.42)
где b – реобаза – минимальное значение возбуждающего тока; при Δt→∞.
При малом импульсе  , то есть IΔt=
, то есть IΔt=  - константа.
- константа.
При Iп=2b, имеем:
 .
.
Величина  называется хронопсия.
называется хронопсия.
В состоянии покоя: потенциал покоя равен 80 мВ; пороговые (j1 - j2) =-50 мВ; потенциал действия ≈ 40 мВ.
5.4. Регистрация биопотенциалов
Развитие микрометодов позволило получить точные данные о тонком строении различных тканей организма и усовершенствовать методики изучения их биофизических характеристик. В частности это относится к регистрации мембранного потенциала. Для этих целей микроэлектрод может быть введен внутрь клетки через прокол в ее мембране. Это позволит изучить не только закономерности возникновения и распространения возбуждения в клетке, но и исследовать физико-химические свойства мембраны, вскрыть закономерности прямого раздражения клетки. Для этого используют неполяризующиеся микроэлектроды, которые подразделяются на металлические и жидкостные (капиллярные), наполненные раствором электролита. Металлические, как правило, покрыты слоем изоляции. Основное преимущество жидкостных микроэлектродов заключается в следующем: заполняющий их электролит создает надежный контакт между плазмой клетки или межклеточной жидкостью и металлическим проводником, идущим на выход усилителя. Для того чтобы убрать электродвижущую силу (ЭДС) поляризации между электролитом и металлом, можно ввести неполяризующийся мостик (в простейшем случае используется система агар-агарового мостика с KCl).
Металлические микроэлектроды могут иметь относительно низкое омическое сопротивление. Они более пригодны, чем жидкостные, для длительных экспериментов, обладают большей механической прочностью и гибкостью. Основной недостаток - возникновение ЭДС поляризации, что приводит к нагреванию биологической жидкости и ее закипанию.
При внутриклеточной регистрации потенциалов, связанной с проколом микроэлектродом клеточной мембраны, диаметр кончика микроэлектрода должен быть менее 0,5 мкм. Такой микроэлектрод должен иметь достаточную механическую прочность, чтобы не сломаться при прохождении через ткань. Диаметр кончика подобных микроэлектродов лежит за пределами разрешающей способности обычного оптического микроскопа. Поэтому микроэлектроды с d ≤ 0,5 мкм называют ультраэлектродами.
Изготовление микроэлектродов. Первый этап изготовления заключается в том, что более толстую стеклянную трубку, нагревая на пламени горелки, вытягивают в капилляр. Внутренний диаметр трубки должен составлять 2/3 наружного диаметра. Растягивание производят ступенчато: сначала до диаметра в 0,3 мкм, а затем быстро, при минимальном нагревании, до 0,2…0,1 мкм. При быстром растяжении после умеренного нагрева получают более тонкостенные капилляры. При медленном растяжении значительно размягченной трубки получают более толстостенные капилляры. Степень размягчения стекла оценивают по степени изгибания трубки во время нагрева и ее цвету.
Для изготовления микроэлектродов с диаметром в доли микрона используют стекла пирекс, которые имеют достаточную механическую прочность, высокое удельное сопротивление и химический нейтралитет. Диэлектрическая постоянная пирекса в несколько раз выше, чем у натриевого стекла.
Заполнение микроэлектродов. В зависимости от поставленных задач, перед проведением исследования применяют различные электролиты для заполнения жидкостных микроэлектродов. Для внутриклеточной регистрации микроэлектроды заполняют изотоническим раствором KCl, а также 1…3%-ым раствором КСl. Для удлинения срока хранения микроэлектродов их надо содержать в темноте при t=5 °C. Для заполнения микроэлектрода последний погружается кончиком в электролит, который кипятят до тех пор, пока весь воздух в капилляре не будет замещен жидкостью.
Микроэлектрод должен быть неполяризующимся, стабильность которого достигается в том случае, когда хлорированное серебро контактируетне непосредственно с электролитом микроэлектрода, а через агар-агаровый мостик. Присоединение микроэлектрода к капилляру, содержащему агар-агар на электролите, может осуществляться посредством резиновой трубки, заполненной для надежного контакта электролитом.
Для приготовления хлорированного серебра лучше всего использовать химически чистую серебряную проволоку диаметром около 1 мм. После тщательной очистки и промывки, участок проволоки, подлежащий введению в микроэлектрод и иногда скручиваемый спиралью, погружают в 0,75 N раствор химически чистой соляной кислоты. На проволоку подается анод постоянного тока. Электрический ток пропускают в течение 3–5 часов. Плотность электрического тока должна составлять приблизительно ≈5 мА/см2 поверхности проволоки, погруженной в раствор. При этом получается гладкое и равномерное покрытие проволоки хлористым серебром. Необходимо производить одновременное хлорирование двух серебряных проволок, одна из которых предназначается для микроэлектрода, а другая – для парного ему референтного (индифферентного) неполяризующегося электрода. Катодом при хлорировании служит специальная серебряная проволока или пластинка. После хлорирования проволоку несколько раз тщательно промывают в дистиллированной воде, затем помещают в проточную воду для удаления следов НС1, после чего снова промывают в дистиллированной воде.
После изготовления оба хлорированных серебряных электрода помещают на несколько дней в раствор Рингера. При этом начальная разница в потенциале снижается или даже может совсем исчезнуть.
Следует иметь в виду, что хлористое серебро растворяется в концентрированном растворе КС1. Поэтому не следует допускать прямого контакта электрода с КС1.
Агар-агар, предназначенный для приготовления высококачественного неполяризующегося микроэлектрода должен пройти следующую обработку. Кусочки сухого агар-агара кладут в мешочек из чистой ткани и помещают в дистиллированную воду на 12 или более часов для набухания. Затем в агар-агар вводят платиновый электрод, а другой платиновый электрод помещают снаружи около мешочка. Через электроды пропускают постоянный электрический ток напряжением 110В в течение 5 часов. Затем ток пропускают еще раз в течение 5 часов в обратном направлении. При этом из агар-агара будут полностью удалены катионы и анионы неорганических примесей (Мещерский К.Т., I960).
Микроэлектроды, заполненные трехмолярным раствором КСl, имеют значительный (до 30…70 мВ) собственный потенциал, возникающий при погружении их кончиков в раствор электролита. Потенциал микроэлектрода имеет отрицательный знак и обычно тем выше, чем больше различие в концентрации внешнего и внутреннего электролита и омическое сопротивление микроэлектрода. Таким образом, при измерении мембранного потенциала обычно допускается значительная ошибка, если не учитывается потенциал кончика микроэлектрода.
Хорошо показала себя методика, в основе которой лежит метод прокалывания движущихся под давлением клеток крови с последующим насаживанием их в виде "бубликов" на острие микроэлектрода.
Само устройство для введения микроэлектрода в клетку создано в виде замкнутой системы трубопроводов, выполненных из индифферентных материалов (рис. 5.6).

Рис. 5.6. Устройство для ввода микроэлектрода в клетку
Трубопроводы размещаются непосредственно в корпусе устройства и содержат резервную камеру с микроотверстием для воздуха. Резервная камера через пропускной клапан соединена с камерой давления с помощью трубопровода. Пропускной клапан не позволяет исследуемой среде возвращаться обратно в резервную камеру при создании давления в системе. Камера давления выполнена в виде цилиндра, в верхней части которого установлен штуцер для подключения пневмоподающего устройства. Снизу камера давления имеет герметическую пробку, которая обеспечивает доступ при промывке и стерилизации камеры давления. На уровне герметической пробки камера давления имеет отверстия, переходящие в трубку диаметром 1 – 2 мм, в которой по центру неподвижно установлен микроэлектрод. Микроэлектрод закрепляется в пробке, герметично закрывающей горизонтальную трубку. Удаленный от камеры давления конец трубки соединен трубопроводом с резервной камерой.
Наличие замкнутой системы позволяет вести исследования среды при неоднократном ее использовании, так как, поступающая из резервной камеры в камеру давления, исследуемая среда под давлением омывает микроэлектрод, и клетки крови автоматически насаживаются на его острие, при условии, если диаметр его значительно меньше диаметра исследуемых клеток. Среда через трубопровод вновь поступает в резервную камеру и может быть использована повторно. Все устройство работает следующим образом.
При определении биопотенциала покоя клеточных мембран подвижных клеток, например эритроцитов, берут необходимое количество крови с 0,1 % цитрата натрия для предупреждения ее свертывания. Полученную исследуемую среду помещают в резервную камеру, из которой через открытый пропускной клапан исследуемая среда перемещается в камеру давления до полного ее заполнения. Перепускной клапан закрывают и через штуцер нагнетают воздух, под действием которого исследуемая среда через трубку поступает по трубопроводу в камеру, омывая при этом микроэлектрод, на который нанизываются клетки, передавая свой биопотенциал на усиливающую и регистрирующую аппаратуру.
Отрицательный электрод в камеру давления пропущен через пробку–винт. Как уже отмечалось, при полном перемещении исследуемой среды цикл повторяют нужное количество раз.
Устройство для автоматического введения микроэлектрода в клетку позволяет:
1) вводить микроэлектрод без утомительных манипуляций в любые клетки, в том числе и клетки крови;
2) изучить изменение биопотенциала покоя различных клеток по степени их травмирования микроэлектродом.
В качестве регистрирующей аппаратуры при проведении исследований можно использовать интегрирующий цифровой вольтметр постоянного тока который пригоден для измерения напряжения постоянного тока, в широком диапазоне напряжений от 10 мкВ до 1000 в с погрешностью ± 0,05%. Измеряемые значения отсчитываются по цифровому табло, прибор работает с автоматическим и ручным запусками; чувствительность прибора 10 мкВ.
Вопросы для самоконтроля
1. Виды биоэлектрических потенциалов? Их природа?
2. Напишите формулы Гендерсона?
3. Какова природа мембранных потенциалов?
4. Потенциал действия? Формула?
5. В чем сущность электракинетических явлений?
6. Дзета-потенциал. Формула Смогуховского-Эйнштейна?
7. Формула Нерста. Потенциал покоя.
8. Какой транспорт ионов создает мембранную разность потенциалов: пассивный или активный?
9. Что больше: скорость распространения электрического сигнала по проводам морского телеграфа или скорость распространения нервного импульса по мембране аксона? Почему?
Тесты текущего контроля
1. Мембранным потенциалом φм называется:
1. φм= φнар- φвн
2. φм= φва- φнар
3. φм= φва- φнар
2. Диаметр кончика внутреннего электрода используемый для измерения мембранного потенциала:
1. Соизмерим с размером клетки;
2. Много меньше размеров клетки;
3. Много больше размеров клетки.
3. Как изменится вид графика потенциалов действия, если поменять химический состав внутри аксона и снаружи: аксоплазму заменить на внутриклеточную жидкость, а внтриклеточную жидкость на аксоплазму? Начертить график.
4. В фазе деполяризации при возбуждении аксона потоки Na+ направлены:
1. Внутрь клетки;
2. Наружу;
3. INa = 0.
5. В фазе реполяризации аксона потоки направлены:
1. Внутрь клетки; -INa+
2. Внутрь клетки; -IK+
3. Наружу; -IK+
4. IK+ = INa+ = 0
5. Наружу –INa+
ЛЕКЦИЯ 6. Специальные методы, используемые для диагностики
6.1 Рентгеновские лучи
Рентгеновским излучением, или рентгеновскими лучами, называют электромагнитное излучение с длиной волны порядка от 80 нм до 0,0001 нм. Со стороны длинных - граничит с ультрафиолетовым излучением, а со стороны коротких волн оно в значительной степени перекрывается ядерным гамма-излучением.
В медицине используется рентгеновское излучение с длиной волны порядка от 10 до 0,005 нм, чему соответствует энергия фотонов порядка от 102 эВ до 0,5 МэВ.
Рентгеновское излучение имеет общие свойства, присущие электромагнитным волнам. Волновая природа рентгеновских лучей (РЛ) была открыта намного позже (1912 г.), чем открытие рентгеновских лучей в 1895 г. немецким ученым Рентгеном. Кроме биологического действия и природы, Рентгеном были даны все основные свойства РЛ:
1) большая проникающая способность;
2) засвечивание фотопластинки;
3) свечение флюоресцирующих экранов;
4) явление ионизации.
Биологическое действие открыто в 1932 году.
По способу возбуждения рентгеновские лучи подразделяются на лучи торможения и характеристические.
Рассмотрим получение РЛ.
Источником Р-излучения является рентгеновская трубка. Она представляет собой стеклянную колбу с высоким вакуумом, давление порядка 10-6-10-7 мм рт. ст., и двумя электродами – анодом и катодом, к которым прикладывается высокое напряжение U≈1000 В. Трубка Кулиджа состоит из анода, который представляет собой металлический стержень, на скошенном торце которого имеется пластинка из металла с высоким атомным номером, называемая зеркальцем.
Не нашли, что искали? Воспользуйтесь поиском: