
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Кислотно-основное титрование.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по курсу физико-химических методов исследования
«Определение карбонатов, гидрокарбонатов и их совместного присутствия методом кислотно-основного титрования»
Ростов-на-Дону
Методические указания по курсу физико-химических методов исследования «Определение карбонатов, гидрокарбонатов и их совместного присутствия методом кислотно-основного титрования». - Ростов н/Д: Рост. гос. строит. ун-т, 2011. - 12 с.
Изложены теоретические вопросы кислотно-основного титрования. Рассчитаны на студентов III курса дневной и заочной форм обучения специальности «Производство стройматериалов».
УДК 541.2
Составители: канд. хим. наук, доц.
Е.А. ЛЕВИНСКАЯ
канд. хим. наук, доц.
М.Н. МИЦКАЯ
Редактор Т.М. Климчук
Темплан 2011 г., поз. 202
Подписано в печать. Формат 60x84/16.
Бумага писчая. Ризограф. Уч.-изд. л. 0,6. Тираж 100 экз. Заказ
Редакционно-издательский центр РГСУ
344 022, Ростов-на-Дону, ул. Социалистическая, 162.
© Ростовский государственный
строительный университет, 2011
Кислотно-основное титрование.
Метод нейтрализации, или метод кислотно-основного взаимодействия, основан на реакции связывания катионов Н+ кислоты ОН- - ионами основания:
Н++ОН-=Н2О.
При титровании происходит изменение рН раствора. Величина рН в точке эквивалентности зависит от природы реагирующих веществ и их концентрации.
Этим методом определяют содержание кислот, оснований, солей слабых кислот и сильных оснований, солей сильных кислот и слабых оснований.
В процессе нейтрализации не происходит изменение окраски раствора, поэтому в кислотно-основном методе используют индикаторы, с помощью которых устанавливают точку эквивалентности.
ИНДИКАТОРЫ МЕТОДА НЕЙТРАЛИЗАЦИИ
Индикаторы - это сложные органические кислоты или основания, при диссоциации которых происходит изменение структуры их молекул.
Область значений рН, в которой индикатор изменяет свою окраску, называется интервалом перехода индикатора. Его можно рассчитать по формуле
рН = рКинд±1
Вместо интервала перехода окраски индикатора пользуются также показателем титрования индикатора (рТ). рТ - это оптимальное значение рН титруемого раствора, при котором наблюдается наиболее резкое изменение окраски индикатора, свидетельствующее об окончании титрования. Значения величины рТ приблизительно совпадают со значениями величин рКинд
Практически индикаторы применяли давно, но первая попытка в объяснении их действия была сделана в 1894 году Оствальдом, создавшим так называемую ионную теорию. Согласно этой теории индикаторы имеют различную окраску в молекулярном и ионном состояниях.
HInd «H++Ind-
окраска 1 окраска 2
При изменении [Н+] равновесие смещается (<[Н+]®; >[Н+]←).
Так как интервал перехода индикаторов зависит от рК, то чем более сильная кислота HInd, тем в более кислой области находится интервал перехода индикатора
Табл 1.
Интервалы перехода некоторых индикаторов
| Индикатор | рТ | Интервал перехода рН | Окраска в средах | рКинд | ||
| нейтральная | кислая | щелочная | ||||
| лакмус | ≤ 5,0-8,0 | фиолетовый | красный | синий | - | |
| фенол-фталеин | 8,0-10,0 | бесцветный | бесцветный | малиновый | 9,2 | |
| метилоранж | 3,1-4,4 | красный | оранжевый | желтый | 3,7 | |
| метиловый красный | 4,4-6,2 | красный | красный | желтый | 5,1 |
При титровании сильной кислоты слабым основанием или слабого основания сильной кислотой титрование следует закончить в кислой среде. В качестве индикатора следует применять лакмус, метиловый оранжевый или метиловый красный, так как они меняют окраску при рН < 7.
При титровании слабой кислоты сильным основанием и сильного основания слабой кислотой в качестве индикатора следует применять фенолфталеин, так как он меняет окраску в щелочной среде.
При титровании сильной кислоты сильным основанием или сильного основания сильной кислотой надо применять индикатор, который изменяет окраску при рН 7 (например, нейтральный красный), или любой индикатор, изменяющий окраску в пределах рН от 4 до 10, так как при их использовании ошибка титрования будет порядка 0,125 %, что вполне допустимо. Для точного выбора индикатора рассчитываются кривые титрования.
Титрование сильной кислоты сильным основанием
Предположим, что для титрования взято 100 мл 0,1 Н раствора НСl, который титруется 0,1 Н раствором NаОН.
| % нейтрализации, (объем раствора NаОН) | [Н+], моль/л | рН |
| 0,1 | 1,00 | |
| 90,0 | 
| 2,28 |
| 99,0 | 
| 3,3 |
| 99,9 | 
| 4,3 |
| 100,0 | 
| 7,0 |
| 100,1 | [ОН-]= 
| 9,7 |
| 101,0 | [ОН-]= 
| 10,7 |
| 110,0 | [ОН-]= 
| 11,7 |
На основании этих данных строят кривую титрования НСl раствором NаОН:

Анализ кривой титрования
-в начале титрования и после точки эквивалентности рН изменяется медленно, а в ТЭ - быстро; скачок титрования - (4.3 - 9.7). Следовательно, титрование сильной кислоты раствором сильной щелочи, возможно, проводить в присутствии метилоранжа, метилового красного и фенолфталеина;
-с повышением концентрации титруемого и стандартного растворов увеличивается скачок титрования. Чем выше температура титруемого раствора, тем меньше скачок титрования.
ЭКСПЕРИМЕНТЛАЛЬНАЯ ЧАСТЬ
ОПЫТ №1 «Определение едких щелочей».
Для определения едкой щелочи можно применять индикаторы метилоранж и фенолфталеин. При титровании протекает реакция:
2NaOH+H2SO4®Na2SO4+2H2O
Методика определения:
Пипеткой Мора отбирают 10 мл контрольной задачи, выливают в коническую колбу, добавляют 1-2 капли метилоранжа и титруют 0,1 Н раствором H2SO4 до неисчезающей слабо-красной окраски.
Объем кислоты, затраченный на титрование, отсчитывают по бюретке:
I титрование: расход H2SO4 …………………. мл
II титрование: расход H2SO4 …………………. мл
Средний расход H2SO4 …………………………мл
Расчет:
1. Определяют нормальность щелочи по формуле:
 =
= 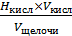
2. Вычисляют титр рабочего раствора по определяемому веществу:
TН2SO4⁄ NaOH =  = ……….. (г/мл)
= ……….. (г/мл)
3. Рассчитывают количество щелочи в исследуемом растворе:
m NaOH= TН2SO4⁄ NaOH  =…………(г/л)
=…………(г/л)
ОПЫТ №2 «Определение гидрокарбонатов».
При титровании гидрокарбонатов (NaHCO3) сильной кислотой необходимо установить рН раствора начале титрования и в точке эквивалентности. Известно, что рН 0,1 Н раствора NaHCO3 в начале титрования равен 8,31. В точке эквивалентности в этом растворе будет находиться H2СO3, получающаяся в результате реакции, протекающей при титровании:
2NaHCO3 + H2SO4= Nа2SO4+2 H2СO3.
рН 0,1н раствора H2СO3 в точке эквивалентности (конец титрования)
имеет значение 3,68. Следовательно, при определении гидрокарбона-
тов применяется индикатор-метилоранж.
Методика определения:
К 10 мл контрольной задачи добавить 1-2 капли метилоранжа, раствор титровать H2SO4 до слабо-красной окраски.
Объем кислоты, затраченный на титрование, отсчитывают по бюретке:
I титрование: расход H2SO4 …………………. мл
II титрование: расход H2SO4 …………………. мл
Средний расход H2SO4 …………………………мл
Расчет:
1. Определяют нормальность гидрокарбоната по формуле:
 =
= 
2. Вычисляют титр рабочего раствора по определяемому веществу:
TН2SO4⁄ NaHCO3 =  = ……….. (г/мл)
= ……….. (г/мл)
3. Рассчитывают количество гидрокарбоната в исследуемом растворе:
m NaHCO3 = TН2SO4⁄ NaHCO3  =…………(г/л)
=…………(г/л)
ОПЫТ №3 «Определение карбонатов».
Водный раствор карбонатов щелочных металлов представляет собой смесь щелочи и карбонатов, растворенных в воде. Щелочь образуется в результате гидролиза карбонатов по уравнению реакции
Na2CО3 + Н2О = NaOH + NaHCО3
При совместном присутствии щелочи и карбонатов титрование производят серной кислотой, устанавливая две точки эквивалентности по двум индикаторам: фенолфталеину и метиловому оранжевому. Сначала кислота нейтрализует щелочь (реакция 1) и половину карбоната натрия (реакция 2), переводя его в гидрокарбонат натрия
2NaOH+H2SO4=Na2SO4+2H2O (1)
2Na2CО3 + H2SO4 = Na2SO4+ 2NaHCО3 (2)
В первой точке эквивалентности образуются негидролизующийся сульфат натрия и гидрокарбонат натрия, гидролизующийся в водном растворе с образованием слабощелочной среды:
NaHCО3 + Н20 = NaOH + Н2О + СО2 (3)
Поэтому первую точку эквивалентности устанавливают по фенолфталеину, отсчитывая по бюретке объем соляной кислоты, израсходованный на титрование всей щелочи и половины карбонатов (V1).
Вторая точка эквивалентности соответствует нейтрализации всей щелочи и всего карбоната, так как объем серной кислоты по бюретке отсчитывается от нулевой отметки. При этом гидрокарбонат натрия нейтрализуется до угольной кислоты:
2NaHC03 + H2SO4= Na2SO4+ H2О + СО2 (4)
Раствор во второй точке эквивалентности содержит нейтральную соль и насыщен углекислым газом, вследствие чего имеет слабокислую реакцию. Поэтому для фиксирования второй точки эквивалентности используется метиловый оранжевый, изменяющий окраску в кислой среде.
Методика определения:
К 10 мл контрольной задачи добавить 1-2 капли фенолфталеина, раствор титровать H2SO4 до обесцвечивания, записывают объем затраченной кислоты. Затем к титруемому раствору добавить 1-2 капли метилоранжа и продолжают титровать H2SO4 до появления до слабо-красной окраски.
Объем кислоты, затраченный на титрование:
I титрование: по ф-ф расход H2SO4 …………………. мл
по м-о расход H2SO4 …………………. мл
V1- общий объем H2SO4 ……………………мл
II титрование: по ф-ф расход H2SO4 …………………. мл
по м-о расход H2SO4 …………………. мл
V2- общий объем H2SO4 ……………………мл
Определяем среднее значение объема H2SO4 на титрование
 (мл).
(мл).
Расчет:
1. Определяют нормальность карбоната по формуле:
 =
= 
2. Вычисляют титр рабочего раствора по определяемому веществу:
TН2SO4⁄ Na2C03=  = ………. (г/мл)
= ………. (г/мл)
3. Рассчитывают количество карбоната в исследуемом растворе:
m Na2C03= TН2SO4⁄ Na2C03  =……… (г/л).
=……… (г/л).
ОПЫТ №4 «Определение карбонатов и гидрокарбонатов при совместном присутствии».
При титровании данной смеси протекают реакции:
Na2CО3 + Н2О = NaOH + NaHCО3 (а)
2NaOH+H2SO4=Na2SO4+2H2O (б)
2NaHCО3 + H2SO4= Na2SO4+ H2О + СО2 (в)
Методика определения:
К 10 мл контрольной задачи добавить 1-2 капли фенолфталеина, раствор титровать H2SO4 до обесцвечивания, записывают объем затраченной кислоты V1, который расходуется на титрование половины карбоната. Затем к титруемому раствору добавить 1-2 капли метилоранжа и продолжают титровать H2SO4 до появления до слабо-красной окраски. При этом кислота расходуется на титрование второй половины карбоната и гидрокарбоната. Отсчитывают объем кислоты V2.
Объем кислоты, затраченный на титрование:
I титрование: по ф-ф расход H2SO4 …………………. мл
по м-о расход H2SO4 …………………. мл
II титрование: по ф-ф расход H2SO4 …………………. мл
по м-о расход H2SO4 …………………. мл
Среднее значение V1………………………………мл
среднее значение V2………………………………мл
Расчет:
1. Определяют объем кислоты, израсходованной на титрование Na2CО3 и NaHCО3. На титрование Na2CО3 израсходовано кислоты: 2V1……(мл).
На титрование NaHCО3 израсходовано кислоты: V2- V1 …………(мл)
2. Вычисляют титр кислоты по определяемым веществам:
TН2SO4⁄ Na2C03=  = ……… (г/мл)
= ……… (г/мл)
TН2SO4⁄ NaHCO3 =  = ……… (г/мл)
= ……… (г/мл)
3. Рассчитывают количество карбоната и гидрокарбоната в исследуемом растворе:
m Na2C03= TН2SO4⁄ Na2C03  =……… (г/л).
=……… (г/л).
m NaHCO3 = TН2SO4⁄ NaHCO3  =……(г/л)
=……(г/л)
Контрольные вопросы и задачи.
1. На чем основана методика определений в титриметрическом анализе? Назовите необходимые условия проведения титрования.
2. Приведите методы установления точки эквивалентности.
3. Как производится выбор индикатора?
4. Является ли молярная масса эквивалентов веществ (эквивалентная масса) постоянной величиной? От чего зависит ее значение?
5. Определите число эквивалентности и молярную массу эквивалентов
H2SО4 в реакциях
H2SО4 + NaOH = NaHSО4, + Н2О
H2SO4+ 2NaOH = Na2SO4 + 2H2О
6. Дайте определение понятия «титр раствора». Рассчитайте титр 1 н. раствора КОН; 0,5 н. раствора НСl.
7. Рассчитайте массовую долю гидроксида натрия в анализируемом образце, если на титрование навески массой 0,2123 г расходуется 21,2 мл 0,2000 н. раствора соляной кислоты.
8. Рассчитайте концентрации ионов Н+ и ОН- в растворе, рН которого равен 2,66.
9. По каким формулам рассчитывают содержание NaOH и Na2C03?
10. Какую навеску соды надо взять для анализа, чтобы на титрование раствора расходовалось 20 мл 0,1 н. раствора соляной кислоты?
11. Рассчитайте массовую долю карбоната натрия в смеси гидроксида и карбоната натрия, если навеска массой 0,7331 г растворена в мерной колбе вместимостью 250 мл. На титрование 25 мл полученного раствора в присутствии метилового оранжевого расходуется 22,25 мл, а в присутствии фенолфталеина — 20,05 мл 0,5 н. раствора соляной кислоты.
| <== предыдущая лекция | | | следующая лекция ==> |
| Соединительная ткань со специальными свойствами | | | Рассмотрен и утвержден на заседании кафедры |
Не нашли, что искали? Воспользуйтесь поиском: