
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Розділ 3 Хімічний склад і розрахунок
Формул мінералів
Кожен мінерал характеризується певним хімічним складом. Мінерали можуть складатися або з одного хімічного елемента, або з декількох. Якщо мінерал складається з одного хімічного елемента, його називають самородним елементом. Наприклад, самородне золото, самородне срібло, самородна мідь і т.д. Проте більшість мінералів складається з декількох, а іноді і багатьох хімічних елементів. Будову мінералів прийнято виражати у вигляді хімічної формули або у вагових процентах, які визначають за допомогою хімічного аналізу.
Наприклад, хімічний склад мінералів халькопіриту і анальциму може бути виражений такими ваговими процентами хімічних елементів(для першого) або окислів (для другого):
I Cu -39,4% II SiO2 55,12%
Fe -30,47% Al2O3 22,99%
S -34,6% Na2O 13,53%
Сума = 99,97% H2O 8,27%
Сума = 99,81%
Формули даних мінералів розраховують діленням вказаних вагових кількостей на відповідні атомні чи молекулярні маси. При цьому отримують атомні чи молекулярні кількості. Атомні маси хімічних елементів беруться з таблиці періодичної системи елементів Д.І.Менделєєва, молекулярна маса окислу виводиться шляхом сумування атомних мас, додаючи відповідний окисел елементів. Атомні чи молекулярні кількості заміняють пропорціональними їм коефіцієнтами в отри-маній формулі. Приклади розрахунку формули халько-піриту і анальциму наводяться в таблиці 3.1. Формули, які отримують при розрахунку і дають уявлення про хімічний склад мінералу, називають емпіричними. Такі отримані формули халькопіриту і анальциму – 4SiO2·Al2O3·Na2O·2H2O. Емпірична формула анальциму, записана у вигляді окислів, не відображає зв’язків між хімічними елементами і нічого не говорить про структуру мінералу. Такий запис формули має одну перевагу – її легше запам’ятати.
Для ряду мінералів прийнято записувати формули, в яких відображається тип хімічного зв’язку і взаємні зв’язки між додаваними хімічними елементами. Такі формули називаються структурними, або кристало-хімічними. Формула анальциму Na[AlSi2O6]·H2O струк-турна. Квадратними дужками виділений радикал, який являє собою складний аніонний комплекс. Вода, яка є в мінералі в кількості однієї молекули, записується в кінці формули і відділяється від неї крапкою. Другий приклад. Емпірична формула мусковіту H2KAl3Si3O12, структурна – KAl2[AlSi3O10](OH,F)2. В даній формулі виділений у вигляді радикала складний аніонний комплекс, а вода наявна в мінералі не у вигляді H2O, а у вигляді гідроксиду (OH)-, який може заміщатися F-. Як уже відмічалося, ізоморфні домішки у формулі мінералу позначаються у круглих дужках і відділяються один від одного комою. Хімічний елемент, який стоїть на першому місці в дужках, наявний у великій кількості. Наприклад, формула анкериту Ca(Mg,Fe)2[CO3]2. Рентгеноструктурний аналіз у даний час дозволив установити структурні формули багатьох мінералів.
При вивченнi хiмiчного складу мiнералiв, поряд з основними структуроутворюючими i другорядними елементами, в них встановлено так званi додатковi iони i вода.
Роль додаткових iонiв, до яких належать Cl-, F-, S2-, (OH)-, Na+, K+ та деякi iншi, полягає в тому, що, розмiщуючись в пустотах або iнших мiсцях кристалчної структури мiнералу, вони компенсують вiдсутнi валентностi як катiонної, так i анiонної груп, при цьому часто змiнюючи як хiмiчнi, так i фiзичнi властивостi мiнералу, в який вони входять. Як приклад можна навести входження в структуру апатиту таких додаткових анiонiв, як (ОН)-, Cl- і F-. Входження цих анiонiв у структуру апатиту веде до того, що утворюються три його рiзновидностi: гідроксилапатит, фторапатит i хлорапатит iз специфiчними властивостями.
Таблиця 3.1 - Перерозрахунок даних хімічного аналізу і установлення формули мінералу
| Ком-понент | Вагові про-центи | Атомні (моле-кулярні) кількості | Відно-шення між атомними (молеку-лярними) кіль- костями | Назва і формула мінералу |
| Cu Fe S | 34,9 30,47 34,6 | 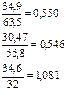
| Халькопірит CuFeS2 | |
| SiO2 Al2O3 Na2O H2O | 55,12 22,99 13,53 8,27 |

| Анальцим 4SiO2·Al2O3·Na2O·2H2O або H4Na2Al2Si4O14=H2NaAlSi2O7= =Na[AlSi2O6]H2O |
Вода, що входить до складу мiнералів, вiдiграє значну роль в їх побудовi. Від її входження до структури мiнералу часто змінюються його фiзичнi та iншi властивостi.
За характером зв’язку в кристалiчних структурах видiляють три основнi типи води: конституцiйний, кристалiзацiйний i адсорбцiйний.
Конституцiйна вода входить до складу кристалiчних структур мiнералiв як структуроутворююча у виглядi іонів (ОН)-, Н+ i Н3О+. Вона видiляється з мiнералу при високих температурах з подальшим розпадом кристалiчної структури. Як приклад, можна навести мусковiт К(Аl)2(ОН)2[AlSi3O10]
Кристалізацiйна вода входить до складу кристалiчної структури не як структуроутворююча, а розміщується у вiльному просторi - пустотах мiж окремими iонами або ж їх групами у виглядi молекул Н2О. ЇЇ видiлення з мiнералу вiдбувається при порiвняно невисоких температурах (до 600°С) i без порушення кристалiчної структури. Типовими прикладами мiнералiв з кристалiзацiйною водою є гiпс - Са[SO4] 2H2O, гiдроборацит - Са, Мg(В6О11] 6Н2O та ряд iнших мiнералiв.
Адсорбційна вода наявна в мiнералах у тріщинах, порах та iнших пустотах у виглядi плiвки i утримується механічними силами поверхневого натягу. Отже, в кристалiчну структуру мінералу вона не входить i видiляється при температурi до 105°С.
Не нашли, что искали? Воспользуйтесь поиском: