
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Неспецифические факторы иммунитета.
Неспецифическая резистентность организма выработалась в процессе длительной эволюции и является свойством всей популяции вида однотипно реагировать на внедрение микроорганизмов, используя для их подавления естественно-физиологические факторы антиинфекционной защиты.
К неспецифическим факторам рузистентности относятся следующие:
● механические
● физико-химические
● иммунобиологические
Механические барьеры, создаваемые кожей и слизистыми оболочками, механически защищают организм от проникновения в него антигенов (бактерий, вирусов, макромолекул). Эту же роль выполняют слизь и реснитчатый эпителий верхних дыхательных путей, освобождающие слизистые оболочки от попавших на них инородных частиц.
Многослойный эпителий здоровой кожи и слизистых оболочек непроницаем для микробов и макромолекулу. Однако при малозаметных микроповреждениях, воспалительных изменениях, укусах насекомых, ожогах и травмах через кожу и слизистые оболочки могут проникать микробы. Вирусы и некоторые бактерии попадают в организм межклеточно и с помощью фагоцитов, переносящих поглощенных микробов через эпителий слизистых оболочек.
Физико-химическим барьером, разрушающим попадающие в организм антигены, являются ферменты, хлористоводородная (соляная) кислота желудочного сока, альдегиды и жирные кислоты потовых и сальных желез кожи.
На чистой и неповреждённой коже обычно содержится мало микробов, так как потовые и сальные железы постоянно выделяют на поверхности кожи вещества, обладающие бактерицидным действием (уксусная, муравьиная, молочная кислота).
Желудок также является барьером для проникающих перорально бактерий, вирусов, антигенов, так как они инактивируются и разрушаются под влиянием кислого содержимого желудка (рН 1,5 – 2,5) и ферментов. В кишечнике инактивирующим фактором служат ферменты, бактериоцины, образуемые нормальной микрофлорой кишечника, а также трипсин, панкреатин, липаза, амилаза и желчь.
Особая роль в антимикробном действии принадлежит ферменту лизоциму. Этот протеолитический фермент, открытый в 1909 г. П.Л.Лащенко и выделенный в 1922 г. А.Флемингом, получил название «мурамидаза», так как разрушает клеточную стенку бактерий и других клеток, вызывая их гибель и способствуя фагоцитозу. Лизоцим вырабатывают макрофаги и нейтрофилы. Содержится он вбольших количествах во всех секретах, жидкостях и тканях организма (кровь, слюна, слёзы, молоко, кишечная слизь, мозг и т.д.). снижение уровня фермента приводит к возникновению инфекционных и других воспалительных заболеваний. В настоящее время осуществлён химический синтез лизоцима, и он используется как медицинский препарат для лечения воспалительных заболеваний.
Иммунобиологическую защиту осуществляют прежде всего фагоцитирующие клетки, поглощающие и переваривающие микрочастицы с антигенными свойствами, а также набор гуморальных компонентов, обеспечивающих неспецифическую защиту: система комплемента, интерферон, защитные белки крови. Существенную роль играют также нормальная микрофлора и воспаление.
Нормальная симбиотическая микрофлора. Состав микрофлоры, населяющей кожу и слизистые оболочки человека, довольно постоянен. Эти микроорганизмы находятся в антагонистических взаимоотношениях с патогенными микробами, препятствуя их размножению и проникновению в организм. Например, лучистые грибы, чудесная палочка выделяют антибиотические вещества (цины) губительно действуя на другие микробы. Кишечная палочка выделяет молочную кислоту, делающую среду обитания микроорганизмов кислой, что препятствует размножению гнилостных и патогенных микробов в кишечнике отношениях
Нормальная микрофлора кишечника участвует в синтезе витаминов, интерференции и стимуляции иммунной системы. Естественным неспецифическим стимулятором иммуногенеза является мурамилдипептид, образующийся из микрофлоры, под влиянием лизоцима и других литических ферментов, находящихся в кишечнике.
Воспаление – многокомнонентная местная сосудисто-тканевая защитно-приспособительная реакция организма на проникновение микробов во внутреннюю среду организма, т.е. ответ тканей на присутствие чужеродных микроорганизмов или повреждение. Представляет собой жизненно важный защитный механизм организма, в котором участвуют фагоциты, антитела и комплемент, накапливающиеся в месте микробной инвазии или повреждения. Скапливающиеся вокруг патогенных микробов фагоциты (лейкоциты) препятствуют распространению микробов в кровоток, подлежащие ткани и внутренние органы.
Острая воспалительная реакция развивается в течение первого часа после повреждения тканей и значительно отличается от пролонгированного (хронического) воспаления. Её классическая формула – rubor, tumor, calor, dolor et function lesa symptomata inflammationis sunt (покраснение, опухоль, повышенная температура, цвет, болезненность и нарушение функции с симптомами воспаления) – употребляется в медицине с античных времён.
Воспалительная реакция и повреждение тканей приводят к тому, что в организме начинают синтезироваться новые белки (медиаторы реакции – интерлейкин-1, интерлейкин-6, цитокины, секретируемые макрофагами) и происходят защитные реакции, сопровождающиеся повышением температуры (лихорадкой), апатией (летаргией) и мышечной слабостью, нейтрофилией (увеличением количества нейтрофилов в крови). В очаге воспаления активируется фагоцитарная реакция.
Фагоцитоз (от греч. рhagos – пожираю, cytos – клетка), открытый и изученный И.И.Мечниковым, обеспечивает резистентность организма, защиту от чужеродных и инородных веществ, в том числе микробов. Механизм фагоцитоза состоит в поглощении, переваривании, инактивации инородных для организма веществ специальными клетками – фагоцитами.
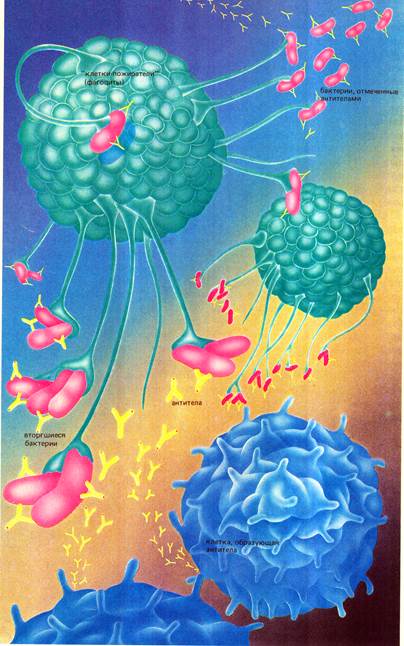 К фагоцитирующим клеткам И.И.Мечников отнёс макрофаги (моноциты крови, гистиоциты, эндотелиальные и ретикулярные клетки внутренних органов) и микрофаги (нейтрофилы, базофилы, эозинофилы) В настоящее время все фагоциты объединены в единую мононуклеарную фагоцитирующую систему. В неё включены тканевые макрофаги (альвеолярные, перитонеальные и др), клетки Лангерганса (белые отростчатые эпидермоциты), и Гренштайна (эпидермоциты кожи), клетки Купфера (звёздчатые ретикулоэндотелиоциты), эпителиоидные клетки, нейтрофилы и эозинофилы крови и др. Переваривающая способность фагоцитов определяется наличием большого набора лизосомальных гидролитических ферментов, разрушающих полимерные молекулы до мономеров.
К фагоцитирующим клеткам И.И.Мечников отнёс макрофаги (моноциты крови, гистиоциты, эндотелиальные и ретикулярные клетки внутренних органов) и микрофаги (нейтрофилы, базофилы, эозинофилы) В настоящее время все фагоциты объединены в единую мононуклеарную фагоцитирующую систему. В неё включены тканевые макрофаги (альвеолярные, перитонеальные и др), клетки Лангерганса (белые отростчатые эпидермоциты), и Гренштайна (эпидермоциты кожи), клетки Купфера (звёздчатые ретикулоэндотелиоциты), эпителиоидные клетки, нейтрофилы и эозинофилы крови и др. Переваривающая способность фагоцитов определяется наличием большого набора лизосомальных гидролитических ферментов, разрушающих полимерные молекулы до мономеров.
Процесс фагоцитоза имеет несколько стадий:
• Миграция и хемотаксис (приближение фагоцита к микробу);
• Адгезия (прилипание фагоцита к микробу)
• Эндоцитоз (поглощение). Поглощение объекта происходит путём инвагинации клеточной мембраны с образованием в цитоплазме фагосом или происходит образование выростов мембраны – псевдоподий, окружающих чужеродную клетку, с последующим формированием вакуоли (фагосомы) и слиянием её с лизосомами (образование фаголизосом);
• Перевариание (процессинг). Инактивация и фермантативное расщепление микроба в фаголизосоме, проявляющееся набуханием, фрагментацией и лизисом с полной деградацией до аминокислот и низкомолекулярных соединений.
После завершения фагоцитоза одна часть разрушенных компонентов микробной клетки удаляется во внеклеточную среду, другая – остаётся на поверхности фагоцитирующей клетки. Если антиген разрушен частично, то вслед за фагоцитозом начинается антителообразование.
Различают завершенный и незавершённый фагоцитоз. При завершённом фагоцитозе происходит полное переваривание и бактериальная клетка погибает. При незавершённом фагоцитозе микробные клетки не погибают, остаются жизнеспособными и даже иногда размножаются в фагоцитах. Это обеспечивается различными механизмами. Так, микобактерии туберкулёза и токсоплазмы препятствуют слиянию фагосом с лизосомами; гонококки, стафилококки и стрептококки нередко устойчивы к действию лизосомальных ферментов, риккетсии и хламидии могут долго персистировать в цитоплазме вне фаголизосомы.
Активность фагоцитов характеризуется фагоцитарным показателем и опсоно-фагоцитарным индексом. Фагоцитарные показатели оцениваются по числу бактерий, поглощенных или переваренных одним фагоцитом в единицу времени. Опсоно-фагоцитарный индекс представляет собой отношение фагоцитарных показателей, полученных с сывороткой, содержащей опсонины, и контролем. Эти показатели используют в клинической практике для определения иммунного статуса человека.
Стимулируют фагоцитоз ингибиторы микробов, нормальные антитела, опсонины, специфические иммуноглобулины, цитокины, соли кальция, магния и другие электролиты, адреналин, гистамин, пирогенные вещества, анаболические гормоны.
Угнетают фагоцитоз ферменты агрессии, капсула бактерий, ацетилхолин, антигистаминные вещества (димедрол), кортикостероиды, алкалоиды.
Гуморальные факторы иммунитета, обеспечивающие врождённую резистентность организма, очень разнообразны. Большинство из них обладает антимикробной активностью. Концентрация их в крови не велика, но при инфицировании может резко возрастать. Вырабатываются они разнообразными клетками, главным образом Т-лимфоцитами; как правило являются полипептидами и обладают широким спектром действия.
Комплемент – сложный комплекс белков сыворотки крови, находящийся обычно в неактивном состоянии и активирующийся при образовании комплекса «антиген-антитело». В состав комплемента входят 20 взаимодействующих между собой белков, 9 из которых являются основными компонентами, их обозначают С1, С2, С3,…,С9.
Механизм активации комплемента очень сложен и представляет собой каскад ферментативных протеолитических реакций, которые протекают в присутствии ионов кальция и магния. В результате образуется цитотоксический комплекс, способный лизировать клетки. Содержание комплемента в сыворотке колеблется в зависимости от пола, возраста, сезона и даже времени суток. У здоровых людей уровень комплемента варьирует незначительно, но у больных может резко повышаться или снижаться.
Система комплемента очень лабильна. Инактивация происходит в течение 2-4 суток даже при хранении сыворотки в холодильнике (+50С). Быстро разрушается комплемент под действием протеаз, на свету, особенно при УФ-облучении, в слабых растворах щелочей и кислот, при нагревании сыворотки до 560С (за 20-30 минут).
Пропердин. (pro и perde – подготавливать к разрушению). Как и комплемент, пропердин сложный белок, обладающий антибактериальной активностью. Действуя совместно с комплементом вызывает лизис бактерий, усиливает фагоцитарную реакцию и воспалительный процесс.
β-лизины – белки сыворотки крови, которые синтезируются протромбоцитами и повреждают цитоплазматическую мембрану бактерий. Обладают бактерицидной активностью к грамположительным бактериям, особенно к аэробным спорообразующим бактериям B.subtilis и B.anthracis (возбудитель сибирской язвы) и клостридиям, коринебактериям, стрептококкам, стафилококкам.
X-лизин, подавляет развитие грамотрицательных бактерий (энтеробактерий, нейссерий).
Лейкины – выделяются лейкоцитами при стимуляции продуктами обмена микробов и другими антигенами. Участвуют в регуляции воспаления, Т-клеточного иммунного ответа, В-клеточного антигенспецифического иммунного ответа, гемопоэза. Активны в отношении грамположительных и грамотрицательных бактерий.
Плакины – сходные с лейкинами вещества выделенные из тромбоцитов.
Эритрин – бактерицидное вещество, выделенное из эритроцитов, активно в отношении дифтерийных бактерий.
Интерферон – белок, который синтезируется клетками иммунной системы и соединительной ткани. Различают 4 типа интерферонов:
• альфа-интерферон, омега-интерферон (синтезируется лейкоцитами) обладают противовирусным и противоопухолевым действием,
• бета-интерферон (вырабатывается фибробластми) активирует естественные клетки-киллеры и фагоциты,
• гамма-интерферон – иммунный, (синтезируется Т-хелперами) усиливает противовирусное и противоопухолевое действие предыдущих. Является важнейшим иммунорегулятором.
Интерфероны не лизируют вирусы, а блокируют их репликацию в клетках. Они вырабатываются клетками, инфицированными вирусами, а также после их стимуляции веществами-интерфероногенами или вакцинами. Интерфероны видоспецифичны: человеческие не влияют на инфекции животных и наоборот.
Интерферон, полученный генно-инженерным способом, называется рекомбинантным. Он широко используется для профилактики и лечения гепатитов, новообразований и иммунодефицитов.
С-реактивный белок получил своё название из-за связывания с С-полисахаридами клеточной стенки пневмококков. Синтезируется гепатоцитами и макрофагами, активирует Т-лимфоциты. Его действие напоминает действие антител. При участии ионов кальция неспецифически связывается с бактериями и грибами. Образовавшийся комплекс активирует комплемент, в результате чего микробы лизируются или опсонируются. Повышение уровня С-реактивного белка указывает на наличие воспалительного процесса.
Лизоцим – протеолитический фермент, который синтезируется макрофагами, нейтрофилами и другими фагоцитирующими клетками, он постоянно поступает в жидкости и ткани организма. Содержится в крови, лимфе, слезах, молоке, сперме, на слизистых оболочках урогенетального тракта, дыхательных путей и ЖКТ. В значительном количестве содержится в репе, хрене, редьке, капусте и других растениях. Обнаружен также, в бактериях и бактериофагах. Лизоцим разрушает клеточную стенку бактерий, что приводит к их лизису и способствует фагоцитозу. Наиболее к нему чувствительны грамположительные бактерии.
Препараты лизоцима используются для лечения гнойно-бактериальных инфекций, местно (конъюнктивиты, риниты, гаймориты и др.) и внутримышечно; получают из куриных яиц. Он усиливает действие антибиотиков, особенно пенициллина.
Факторы неспецифической резистентности участвуют в защите от любых антигенов независимо от их природы и характера. Они не имеют специфической направленности действия применительно к конкретному антигену, поэтому их называют факторами неспецифической резистентности.
Специфическая защита осуществляется комплексом специальных форм реагирования иммунной системы. направленных против конкретного антигена.
Антигены.
Термин «антиген» был предложен в 1899 г Л.Детре-Дейчем для обозначения веществ, вызывающих образование антител. Так называют молекулы, которые индуцируют иммунный ответ, и молекулы, вступающие во взаимодействие с антителами и Т-лимфоцитами. Таким образом, под термином антиген следует понимать генетически чужеродные для организма вещества, вызывающие в нем иммунные реакции, направленные на его устранение.
Антигены попадают в организм различными путями: через кожные покровы или слизистые оболочки, непосредственно во внутреннюю среду, минуя покровы или образовываясь внутри организма. Они распознаются иммуннокомпетентными клетками и вызывают разнообразные иммунологические реакции, направленные на их инактивацию, разрушение и удаление.
Антигены обладают следующими свойствами:
● антигенностью, т.е способность антигена индуцировать в организме иммунный ответ, в частности выработку антител (способность к специфическому взаимодействию с эффекторами иммунного ответа);
● специфичностью - способностью избирательно реагировать со специфическими антителами или сенсибилизированными лимфоцитами, появляющимися после иммунизации. При этом взаимодействие происходит не со всей молекулой антигена, а только с её небольшим участком, который получил название «антигенная детерминанта», или «эпитоп»;
● иммуногенностью, т.е. способностью вызывать иммунную защиту организма. Степень иммуногенности зависит от самого антигена:
- чужеродность. Чем дальше в филогенетическом развитии отстоят организмы друг от друга, тем большей иммуногенностью обладают их антигены по отношению друг к другу.
- природа антигена. Наиболее выраженными иммуногенными свойствами обладают белки.
- относительная молекулярная масса антигена. Небольшие полипептидные молекулы с массой менее 5 000, как правило, не иммуногены, в то же время полисахарид с молекулярной массой 600 000 D (дальтон) хорошо индуцирует иммунную реакцию в организме человека.
- структура антигена. При равной молекулярной массе (около 70 000 D)альбумин является более сильным антигеном, чем гемоглобин. Белок коллаген (330 000 D) обладает значительно меньшей иммуногенностью по сравнению с альбумином, масса которого почти в 5 раз меньше.
- растворимость антигена. Высокомолекулярные белки, такие как кератин и меланин, не могут быть получены в виде коллоидного раствора, и они не являются антигенами.
На иммунный ответ влияет динамика поступления антигена в организм, способ его введения и его количество: чем больше антигена, тем более выражен иммунный ответ. Однако при слишком большой дозе антигена может наступить иммунологическая толерантность, т.е. отсутствие ответа организма на антигенное раздражение. Иммуногенность зависит также от состояния макроорганизма. Хорошо известно, что результат иммунизации в определённой мере связан с генотипом особи, его функциональным состоянием.
Различают полноценные и неполноценные антигены.
Полноценные антигены вызывают полноценный иммунный ответ (обладают выраженной антигенностью, иммуногенность и специфичностью). Это в основном белки и экзотоксины бактерий.
Неполноценные антигены – обладают низкой иммуногенностью и при введении в организм не способны индуцировать иммунный ответ. Однако свойство антигенности они не утратили, что позволяет им специфически взаимодействовать с антителами и лимфоцитами. Их делят на гаптены и полугаптены.
Гаптенами могут быть химические вещества с низкой молекулярной массой или более сложные вещества, не обладающие свойствами полного антигена: некоторые бактериальные полисахариды, полипептид туберкулёзной палочки, липиды, ДНК, РНК.
Полугаптены – неорганические радикалы (йод, бром, нитрогруппа, азот и т.д.), которые присоединившись в белковой молекуле, могут менять иммунологическую специфичность белка. Такие йодированные или бромированные белки вызывают образование антител, специфичных к йоду и брому соответственно.
Антигены бактерий.
По специфичности все известные антигены подразделяются на групповые, видовые и типовые.
Типовые антигены – антигены, принадлежащие отдельным особям внутри одного вида.
Видовые антигены – антигены, принадлежащие всем особям одного вида.
Видовые и типовые антигены обладают высокой специфичностью. В ответ на их введение в организм животных вырабатываются только такие антитела, которые реагируют с антигенами определённого вида или разновидности.
Групповые (межвидовые) антигены – антигены, принадлежащие нескольким видам внутри одного рода или семейства. Строгой специфичностью не обладают. Установлено наличие общих антигенов эритроцита человека с антигенами пиогенных кокков, энтеробактерий, возбудителя чумы, вирусов оспы, гриппа и многих других микроорганизмов.
Явление общности антигенной структуры веществ у разных видов получило название антигенной мимикрии. Антигенная мимикрия способствует проникновению, размножению патогенных микробов в организме, усугубляет течение инфекционных болезней, ибо организм утрачивает способность быстро различать чужое, в результате чего замедляется и запаздывает выработка иммунитета. Наличие антигенной мимикрии объясняет длительное выживание патогенных микробов в организме человека, резидентное бактерионосительство и поствакцинальные осложнения.
В структуре бактериальной клетки различают жгутиковые (H-), соматические (О-), капсульные (К-) и некоторые другие антигены.
Жгутиковый (Н - антиген) локализован в локомоторном аппарате бактерий – жгутиках. Состоит из белка флагеллина, термолабилен – при нагревании быстро разрушается и теряет свою специфичность.
Соматический (О – антиген) связан с клеточной стенкой бактерий. Его основу составляют диполисахариды, что придаёт ему термостабильность, и он не разрушается при кипячении.
Капсульные (К – антигены) гетерогенная группа антигенов, которые располагаются на поверхности клеточной стенки, встречаются у бактерий, образующих капсулу; характеризуют групповую и типовую принадлежность бактерий. Некоторые из них термостабильны, другие – термолабильны.
Вариантом капсульного антигена является Vi – антиген (антиген вирулентности). Его можно обнаружить на поверхности возбудителя брюшного тифа и некоторых других энтеробактерий, которые обладают высокой вирулентностью.
Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, которые секретируются бактериями в окружающую среду.
В антигеном составе некоторых бактерий выделяется группа антигенов с сильно выраженной иммуногенностью, названных протективными. Протективные антигены состоят из веществ белковой природы и нуклеиновых кислот, обнаружены у возбудителей сибирской язвы, чумы, бруцеллёза, туляремии, коклюша.
Антитела.
 Одной из основных форм иммунного ответа на внедрение в организм антигена является синтез антител. Антитела – особый класс белков, относящийся к γ-глобулиновой фракции сыворотки крови, называемых иммуноглобулинами (Ig), которые вырабатываются под влиянием антигенов и обладают специфичностью специфически реагировать с ними. Они синтезируются В-лимфоцитами и их потомками – плазматическими клетками.
Одной из основных форм иммунного ответа на внедрение в организм антигена является синтез антител. Антитела – особый класс белков, относящийся к γ-глобулиновой фракции сыворотки крови, называемых иммуноглобулинами (Ig), которые вырабатываются под влиянием антигенов и обладают специфичностью специфически реагировать с ними. Они синтезируются В-лимфоцитами и их потомками – плазматическими клетками.
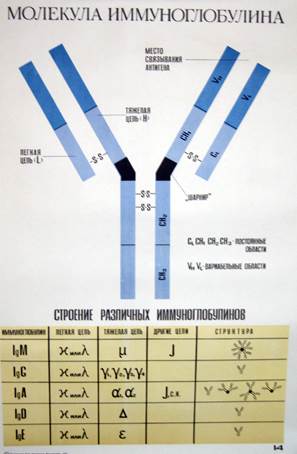
Молекулы иммуноглобулинов, несмотря на их видимое разнообразие, имеют универсальное строение и состоят из двух пар полипептидных цепей: две тяжелые (Н) и две лёгкие (L) цепи. Тяжелые и лёгкие цепи соединены между собой попарно дисульфидными (– S – S –) связями.
Вторичная структура полипептидных цепей молекулы иммуноглобулинов имеет доменное строение: отдельные участки цепи свёрнуты в глобулы (домены), которые соединены линейными фрагментами. Домены стабилизированы внутренней дисульфидной связью. Таких доменов в составе тяжёлой цепи бывает четыре-пять, а в лёгкой – два.
Домены различаются по постоянству аминокислотного состава. Выделяют С-домены с неизменной, постоянной структурой полипептидной цепи и V- домены, с переменной структурой. Вариабельные домены лёгкой и тяжёлой цепи совместно образуют участок (Fab-фрагмент), который специфически связывается с антигеном (антигенсвязывающий, активный центр). В каждой молекуле антитела имеется Fc-фрагмент, который отвечает за взаимодействие с комплементом и его активацию, за связывание с рецепторами на мембране клеток макроорганизма и некоторых микробов.
Взаимодействие молекулы иммуноглобулина с антигеном происходит за счёт ограниченного участка – антигенсвязывающего центра, который взаимодействует не со всей молекулой антигена, а лишь с её антигенной детерминантой. Эффективность взаимодействия антитела с антигеном зависит от условий, в которыйх происходит реакция, прежде всего от рН среды, осмотической плотности, солевого состава и температуры среды.
В зависимости от строения тяжёлой цепи различают пять классов, или изотипов иммуноглобулинов: Ig G, Ig М, Ig А, Ig Е, Ig D.
Иммуноглобулины класса G (Ig G) составляют основную массу иммуноглобулинов сыворотки крови (70-80%), могут проходить через плацентарный барьер и обеспечивают гуморальный иммунитет новорождённых в первые, 3-4 месяца после рождения. Ig G появляются в большом количестве при вторичном иммунном ответе, поэтому составляют основную массу антител против бактерий, их токсинов и вирусов.
Концентрация Ig G возрастает при инфекционных болезнях, аутоиммунных расстройствах, снижается при некоторых опухолях, агаммаглобулинемии.
Препараты Ig G (в чистом виде) применяются с заместительной целью при дефиците этих иммуноглобулинов и в случае тяжёлых инфекций. Они используются для лечения аллергических и аутоиммунных заболеваний, так как подавляют иммунный ответ. Следовательно, эти иммуноглобулины выполняют регуляторную роль, создавая условия для нормального иммунного ответа.
Иммуноглобулины класса М (Ig М) наиболее крупные из всех иммуноглобулинов. На их долю приходится около 5-15% всех сывороточных иммуноглобулинов. Являются филогенетически наиболее древним иммуноглобулином, синтезируются предшественниками и зрелыми В-лимфоцитами. Образуются в начале иммунного ответа, первыми начинают синтезироваться в организме новорождённого, не проходят через плаценту. Обнаружение специфических антител типа Ig М в сыворотке крови новорождённого указывает на бывшую внутриутробную инфекцию или дефект плаценты.
Иммуноглобулины класса А (Ig А) существуют в сывороточной и секреторной форме. На долю сывороточного Ig А приходится 10-15% всех сывороточных иммуноглобулинов. Около 60% всех Ig А содержится в секретах слизистых оболочек. Секреторный Ig А – основной фактор местного иммунитет слизистых оболочек желудочно-кишечного тракта. Мочеполовой системы и респираторного тракта. Этот иммуноглобулин препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых оболочек, опсонируют микробные клетки и усиливают фагоцитоз. Кроме того, они препятствуют адсорбции и репродукции вирусов в клетках эпителия. Ежедневно в слизистой оболочке кишечника синтезируется до 3г секреторного Ig G. Большое количество его выделяется со слизью из носа. Новорожденные получают секреторный Ig G с молоком матери.
 Иммуноглобулины класса Е (Ig Е) называю реагинами. Они составляют около 0,002% всех циркулирующих иммуноглобулинов. Ig Е синтезируются зрелыми В-лимфоцитами и плазматическими клетками преимущественно в лимфоидной ткани бронхолёгочного дерева и желудочно-кичешного тракта, не проходят через плаценту. Ig Е обладают выраженной цитофильностью – сродством к тучным клеткам и базофилам, участвуют в развитии аллергических реакций немедленного типа.
Иммуноглобулины класса Е (Ig Е) называю реагинами. Они составляют около 0,002% всех циркулирующих иммуноглобулинов. Ig Е синтезируются зрелыми В-лимфоцитами и плазматическими клетками преимущественно в лимфоидной ткани бронхолёгочного дерева и желудочно-кичешного тракта, не проходят через плаценту. Ig Е обладают выраженной цитофильностью – сродством к тучным клеткам и базофилам, участвуют в развитии аллергических реакций немедленного типа.
Иммуноглобулины класса D (Ig D) практически полностью содержатся в сыворотке крови (0,2%). Ig D не проходят через плацентарный барьер, являются рецепторами предшественников В-лимфоцитов. Количество Ig D увеличивается при некоторых вирусных инфекциях.
Антителообразование. Иммуноглобулины синтезируются плазмоцитами, которые образуются в результате дифференцировки полипотентной стволовой клетки. Плазмоцит синтезирует как неиммунный, так и иммунный γ-глобулин. Информацию о специфичности синтезируемого иммуноглобулина плазмоциты получают от В-лимфоцитов. Легкие и тяжелые цепи синтезируются в полисомах плазмоцитов отдельно и соединяются в единую молекулу перед выделением из клетки. Выделение иммуноглобулина из плазмоцита осуществляется путём экзоцитоза или клазматоза т.е. отпочковывания части цитоплазмы с иммуноглобулином. Каждый плазмоцит синтезирует до 2 000 молекул антител в секунду, которые поступают в лимфу, кровь, тканевую жидкость.
Процесс выработки антител, их накопления и исчезновения имеет определённые характеристики; при этом выделяют первичный и вторичный иммунный ответ.
Первичный иммунный ответ характеризуется появлением антител спустя 1-4 дня после антигенного раздражения (латентная, или индуктивная, фаза), затем наступает продуктивная фаза – период логарифмического возрастания количества антител, заканчивающийся периодом максимума (5-15 сутки), когда их количество в крови достигает наибольшего уровня. Спустя 1-3 месяца и позже концентрация антител в крови уменьшается (период снижения).
В случае повторного контакта с тем же антигеном, организм отвечает усиленной выработкой иммуноглобулинов. Эта реакция получила название вторичного иммунного ответа и базируется на иммунологической памяти. для вторичного ответа характерна укороченная латентная фаза – от нескольких часов до 1-2 суток. Логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител.
Динамика и интенсивность антителообразования в значительной степени зависят от иммуногенности и дозы антигена, способа и кратности его введения. А также состояния макроорганизма. Попытка повторного введения антигена в латентной фазе может привести к иммунологическому параличу.
Не нашли, что искали? Воспользуйтесь поиском: