
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
АЛЮМИНИЙ. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
Алюминий – серебристо-белый металл, плотность алюминия 2, 7 г/см3. Относится к легким металлам. Он очень пластичен, легко прокатывается в фольгу и протягивается в проволоку. Прекрасный проводник электрического тока – его электрическая проводимость сравнима с электрической проводимостью меди.
Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида Al2O3. Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск).
Алюминий весьма активен, если нет защитной пленки Al2O3, инертного в химическом отношении вещества.
Если удалена защитная пленка, то алюминий энергично реагирует с водой:
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2↑
- легко окисляется:
4 Al + 3 O2 = 2 Al2O3 пленка предохраняет металл от дальнейшего окисления
- легко растворяется в кислотах:
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
любой
концентрации
t0
2 Al + 3 H2SO4 = Al2 (SO4)3 + 3 H2↑
разб. небольшое
нагревание
Al + 4 HNO3 = Al (NO3)3 + NO + 2 H2O
разб.
- алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием алюминатов:
2 Al + 2 NaOH + 6 H2O = 2 Na [Al (OH)4] + 2 H2↑
тетрагидроксо-
алюминат натрия
Выводы:
1.В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает 1-ое место среди металлов и 3-ье среди всех элементов (после кислорода и кремния).
2.Важнейшие природные соединения алюминия:
а) Алюмосиликаты, боксит, корунд,глинозем,прозрачные кристаллы корунда: красные рубины, синие – сапфиры, которые используют как драгоценные камни.
3.Алюминий присутствует почти во всех органах и тканях человека.
4.Принимает участие в построении эпителиальной и соединительной ткани, в процессах регенерации костей, в обмене фосфора.
5.Повышает общую кислотность, и переваривающую способность желудочного сока, увеличивает содержание соляной кислоты в желудочном соке.
6.Алюминий – серебристо-белый металл, плотность алюминия 2, 7 г/см3. Относится к легким металлам. Он очень пластичен, легко прокатывается в фольгу и протягивается в проволоку. 7.Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида Al2O3. Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск).
8.Алюминий весьма активен, если нет защитной пленки Al2O3, инертного в химическом отношении вещества.
| 14.Соединения алюминия.Качественная реакция на катион алюминия. |
Оксид алюминия Al2O3 – белое вещество с очень высокой температурой плавления. Обладает амфотерными свойствами. Может быть получен разложением при нагревании соответствующего ему амфотерного гидроксида Al (OH)3:
t0
2 Al (OH)3 = Al2O3 + 3 H2O
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
Al2O3 + 2 NaOH = 2 NaAlO2 + H2O
Al2O3 + 2 NaOH + 3 H2O = 2 Na [Al (OH)4]
Гидроксид алюминия – объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах.
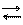

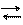
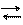 Al+3 + 3 OH- Al (OH)3 H3AlO3 HAlO2 + H2O H+ + AlO2- + H2O
Al+3 + 3 OH- Al (OH)3 H3AlO3 HAlO2 + H2O H+ + AlO2- + H2O
ортоалюминиевая матаалюминиевая
к-та к-та
Соли алюминия и алюминаты гидролизуются:
Al (OH)3 + 3 HCl = AlCl3 + 3 H2O
Al (OH)3 + NAOH = Na [Al (OH)4)]
тетрагидроксоалюминат натрия
t0
Al (OH)3 + NaOH = NaAlO2 + 2 H2O
метаалюминат
натрия
Выводы:
1.Оксид алюминия Al2O3 – белое вещество с очень высокой температурой плавления. 2.Обладает амфотерными свойствами.
3.Гидроксид алюминия – объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах.
15.Применение соединений алюминия в медицине.
1. Алюминия гидроокись – обладает антацидным, адсорбирующим и обволакивающим свойствами. Применяется в антацидной терапии заболеваний желудочно-кишечного тракта.
2. Алмагель. Комбинированный препарат, каждые 5 мл которого содержат 4, 75 мл приготовленного специальным способом геля алюминия гидроокиси и 0, 1 г магния окиси с добавлением Д-сорбита.
Применяют при язвенной болезни желудка и 12-ти перстной кишки, острых и хронических гиперацидных гастритах, эзофагните и др. Желудочно-кишечные заболевания при которых показано уменьшение кислотности и протеолитической активности желудочного сока.
Алмагель-А содержит дополнительно на каждые 5 мл геля 0, 1 г анестезина. Применяют в том случае, если указанные заболевания сопровождаются тошнотой, рвотой, болезненностью.
3. М аалокс. Комбинированный препарат в виде таблеток, содержащих по 0, 4 г алюминия гидроокиси и магния гидроокиси или суспензии. По сравнению с Алмагелем более эффективен, его действие более продолжительно.
4. Гастал. Таблетки, содержащие 0, 45 г Al (OH)3 в сочетании с магния карбонатом и магния окисью (0, 3). Сочетание действующих веществ обеспечиванет высокий антацидный эффект и уменьшение возможности запора.
5. Протаб. По действию, составу и показаниям к применению близок к Маалоксу, Гасталу и др. аналогичным препаратам.
6. Фосфалюгель. Коллоидный гель, содержащий алюминия фосфат (около 23 %). В состав препарата входит гель пектина и агар-агара.
Препарат обладает обволакивающим действием и антацидной активностью, способствующими защите слизистой оболочки желудка. Применяют при язвенной болезни желудка и 12-ти перстной кишки, гастрите, диспепсии, пищевых интоксикациях.
7. Жидкость Бурова (алюминия ацетата 8 % раствор). Препарат алюминия для наружного применения. Оказывает вяжущее и местное противовоспалительное действие, в большой концентрации обладает умеренными антисептическими свойствами. Применяют наружно в разведенном виде (в 10-20 раз и более) для полосканий, примочек, спринцеваний при воспалительных заболеваниях кожи и слизистых оболочек.
8. Квасцы (алюмо-калиевые квасцы). Применяют наружно в качестве вяжущего средства в водных растворах (0, 5 – 1 %) для полосканий, спринцеваний, промываний, примочек при воспалительных заболеваниях кожи и слизистых оболочек. Назначают также в виде карандашей для прижиганий при трахоме и как кровоостанавливающее средство при порезах (при бритье).
9. Квасцы жженые. Применяют для присыпок как вяжущее и высушивающее средство (при потливости ног и т.д.).
Выводы:
1.Алюминия гидроокись – обладает антацидным, адсорбирующим и обволакивающим свойствами. Применяется в антацидной терапии заболеваний желудочно-кишечного тракта.
2.Алмагель.
Применяют при язвенной болезни желудка и 12-ти перстной кишки, острых и хронических гиперацидных гастритах, эзофагните и др. М аалокс. Комбинированный препарат в виде таблеток, содержащих по 0, 4 г алюминия гидроокиси и магния гидроокиси или суспензии. По сравнению с Алмагелем более эффективен, его действие более продолжительно.
3.Гастал. Таблетки, содержащие 0, 45 г Al (OH)3 в сочетании с магния карбонатом и магния окисью (0, 3). Сочетание действующих веществ обеспечиванет высокий антацидный эффект и уменьшение возможности запора.
4.Фосфалюгель.
Препарат обладает обволакивающим действием и антацидной активностью, способствующими защите слизистой оболочки желудка. Применяют при язвенной болезни желудка и 12-ти перстной кишки, гастрите, диспепсии, пищевых интоксикациях.
Вопросы для самоконтроля:
1. Что называется адсорбцией?
2. Что называется аллотропией?
3. Назовите высшую валентность углерода и кремния. Какие степени окисления могут проявлять эти элементы?
4. Назовите кислородные соединения углерода.
5. Образует ли углерод соединения с водородом?
6. К какому типу оксидов относятся оксид углерода (IV), оксид кремния (IV)?
7. Какие кислоты им соответствуют, и какими эти кислоты являются (сильными или слабыми)?
8. Какую реакцию среды имеет раствор карбоната натрия?
9. Какие соли лучше растворяются в воде: карбонаты или гидрокарбонаты?
10. Что является реактивом на карбонат и гидрокарбонат-ионы?
11. Какие кислородосодержащие соединения бора вы знаете?
12. Перечислите боросодержащие кислоты.
13. Какая кислота является наиболее устойчивой?
14. Как называются соли борных кислот?
15. Какая соль является наиболее устойчивой?
16. Какая реакция называется реакцией этерификации?
17. Назовите реактив на борат-ион.
18. К каким гидроксидам относится гидроксид алюминия?
19. Как доказать амфотерный характер гидроксида алюминия?
Тестовые задания для самоконтроля:
Не нашли, что искали? Воспользуйтесь поиском: