
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гибридизация атомных орбиталей
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных [7]) орбиталей, одинаковых по энергии и форме.
Гибридизация атомных орбиталей происходит при образовании ковалентной связи между атомами.
Гибридные орбитали имеют форму объёмной несимметричной восьмёрки, сильно вытянутой в одну сторону от атомного ядра:

Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей атома с орбиталями других атомов и приводит к образованию более прочных связей. Поэтому энергия, затрачиваемая на гибридизацию, с избытком компенсируется выделением энергии за счёт образования более прочных ковалентных связей с участием гибридных атомных орбиталей. Название гибридных орбиталей определяется числом и типом участвующих в гибридизации атомных орбиталей, например: sp-, sp2-, sp3-, sp2d-, spзd2-гибридизация.
Число гибридных орбиталей равно суммарному числу исходных атомных орбиталей.
Направленность гибридных атомных орбиталей в пространстве, а следовательно, и геометрия молекулы зависят от типа гибридизации. На практике обычно решается обратная задача: вначале экспериментально устанавливается геометрия молекул, после чего описываются тип и форма атомных орбиталей, участвующих в её образовании.
sp-Гибридизация. Два гибридных sp-облака в результате взаимного отталкивания располагаются относительно ядра атома таким образом, что угол между ними составляет 180° (рис. 7).


Рис. 7. Взаимное расположение в пространстве двух sp-орбиталей одного атома: а — поверхности, охватывающие области пространства, где вероятность пребывания электрона составляет 90%; б — условное изображение.
В результате такого расположения гибридных облаков молекулы состава АХ2, где А является центральным атомом, имеют линейную конфигурацию, то есть связи ядер всех взаимодействующих атомов располагаются на одной прямой. Например, находятся в состоянии sp-гибридизации валентные электронные орбитали атома бериллия в линейной молекуле ВеС12 (рис. 8). Линейную конфигурацию вследствие sp-гибридизации валентных электронных орбиталей имеют также молекулы ВеВг2, Ве(СН3)2, ZnCl2, CO2 и ряд других.


Рис. 8. Трёхатомная линейная молекула в газообразном хлориде бериллия ВеС12: 1 — Зр-орбиталь атома Cl; 2 — две sp-гибридные орбиталь атома Be
 sр2-Гибридизация. Рассмотрим гибридизацию одной s-opбитали и двух р-орбиталей. В этом случае в результате линейной комбинации трёх исходных орбиталей возникают три гибридные sр2 -орбитали. Они располагаются в одной плоскости под углом 120° друг к другу (рис. 9). sр2 -Гибридизация характерна для многих соединений бора, который, как было показано выше, имеет в возбуждённом состоянии три неспаренных электрона: один s - и два р -электрона. При перекрывании sр2 -орбиталей атома бора с орбиталями других атомов образуются три ковалентные связи, равноценные по длине и энергии. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sр2 -гибридизации, имеют форму плоского треугольника. Углы между связями равны 120°. В состоянии sр2 -гибридизации находятся валентные орбитали атомов бора в молекулах BF3, BC13, атомов углерода и азота в анионах СО32-, NO3-.
sр2-Гибридизация. Рассмотрим гибридизацию одной s-opбитали и двух р-орбиталей. В этом случае в результате линейной комбинации трёх исходных орбиталей возникают три гибридные sр2 -орбитали. Они располагаются в одной плоскости под углом 120° друг к другу (рис. 9). sр2 -Гибридизация характерна для многих соединений бора, который, как было показано выше, имеет в возбуждённом состоянии три неспаренных электрона: один s - и два р -электрона. При перекрывании sр2 -орбиталей атома бора с орбиталями других атомов образуются три ковалентные связи, равноценные по длине и энергии. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sр2 -гибридизации, имеют форму плоского треугольника. Углы между связями равны 120°. В состоянии sр2 -гибридизации находятся валентные орбитали атомов бора в молекулах BF3, BC13, атомов углерода и азота в анионах СО32-, NO3-.

Рис. 9. Взаимное расположение в пространстве трёх sр2 -гибридных орбиталей.
sр3-Гибридизация. Очень большое распространение имеют молекулы, в которых центральный атом содержит четыре sр3 -орбитали, образующиеся в результате линейной комбинации одной s-орбитали и трёх р -орбиталей. Четыре sр3 -орбитали располагаются под углом 109,28′ друг к другу. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома (рис. 10 а).
Образование четырёх равноценных ковалентных связей за счёт перекрывания sр3 -орбиталей с орбиталями других атомов характерно для атома углерода (СН4, CF4, CC14), что очень важно в органической химии. Тетраэдрическую структуру имеют также молекулы других соединений элементов IVA–группы: SiH4, GeH4, SiF4, SiBr4, GeCl4 и т. п.

Рис. 10. Влияние несвязывающих электронных пар на геометрию молекул:
a – метан, несвязывающих электронных пар нет;
б — аммиак, одна несвязывающая электронная пара;
в — вода, две несвязывающие пары
Неподелённые электронные пары гибридных орбиталей. Во всех рассмотренных примерах гибридные орбитали были заселены неспаренными электронами. Однако нередки случаи, когда гибридная орбиталь занята несвязывающей электронной парой. Это оказывает влияние на геометрию молекул. Поскольку несвязывающая электронная пара испытывает воздействие ядра только своего атома, а связывающие пары находятся под действием двух ядер, несвязывающая электронная пара находится ближе к ядру, чем связывающие. В результате этого несвязывающая электронная пара сильнее отталкивает связывающие электронные пары, чем те отталкивают друг друга. Графически для наглядности большую отталкивающую силу, действующую между несвязывающей электронной парой и связывающими электронными парами, можно изобразить большим по объёму электронным облаком несвязывающей пары. Несвязывающая электронная пара имеется, например, у атома азота в молекуле аммиака (рис. 10 б). В результате взаимодействия со связывающими парами углы между связями Н—N—Н сокращаются до 107,78° по сравнению со 109,5°, характерными для правильного тетраэдра.
Ещё большее отталкивание испытывают связывающие электронные пары в молекуле воды, где у атома кислорода имеются две несвязывающие электронные пары. В результате этого угол Н—О—Н в молекуле воды равен 104,5° (рис. 10 в).
Если несвязывающая электронная пара в результате образования донорно-акцепторной связи превращается в связывающую, то силы отталкивания между этой новой связью и другими связями в молекуле становятся одинаковыми, выравниваются и углы между связями. Это происходит, например, при образовании катиона аммония из молекулы аммиака.
Участие в гибридизации d-орбиталей. Если энергии орбиталей одного из d-подуровней атома не очень сильно отличаются от энергий s- и р-орбиталей, то d-орбитали также могут участвовать в гибридизации. Самым распространённым типом гибридизации с участием d-орбиталей является sр3d2-гибридизация, в результате которой образуются шесть равноценных по форме и энергии гибридных облаков (рис. 11 а), расположенных под углом 90◦ и направленных к вершинам октаэдра, в центре которого находится ядро атома. Октаэдр (рис. 11 б) – правильный восьмигранник. Все рёбра в нём равной длины, все грани — правильные треугольники.

Рис.11. sр3d2-Гибридизация
Реже встречается sр3d-гибридизация, в результате которой образуются пять гибридных облаков (рис. 12 а), направленных к вершинам тригональной бипирамиды (рис. 12 б).Тригональная бипирамида — это две равнобедренные пирамиды, соединённые общим основанием. Основание — правильный треугольник. Полужирными штрихами на рис. 12, отмечены ребра равной длины. Геометрически и энергетически sр3d-гибридные орбитали неравноценны: три экваториальные орбитали направлены к вершинам треугольника, а две аксиальные — вверх и вниз перпендикулярно плоскости треугольника (рис. 12в). Углы между экваториальными орбиталями равны 120°, как при sр2-гибридизации. Углы между аксиальной и любой из экваториальных орбиталей имеют другую градусную меру, они равны 90°. Соответственно этому ковалентные связи, которые образуются с участием экваториальных орбиталей отличаются по длине и по энергии от связей, в образовании которых участвуют аксиальные орбитали. Например, в молекуле РС15 аксиальные связи имеют длину 214 пм, а длина экваториальных связей 202 пм.

Рис. 12. sр3d-Гибридизация
Таким образом, рассматривая ковалентные связи между атомами как результат взаимодействия АО, можно объяснить форму возникающих при этом частиц, которая зависит от числа и типа АО, участвующих в образовании связей. Концепцию гибридизации АО, необходимо понимать, что гибридизация представляет собой условный приём, позволяющий наглядно объяснить структуру молекулы посредством комбинации АО.
Полярность
Ковалентная связь бывает полярной и неполярной.
Неполярная ковалентная связь образуется между атомами элементов, имеющих одинаковую электроотрицательность (ЭО)[8]. В этом случае электронная плотность молекулярной орбитали (МО) распределена симметрично вокруг ядер соединяющихся атомов.
Неполярная связь реализуется прежде всего в молекулах простых веществ: Н2, O2, Cl2, N2, а также между одинаковыми атомами в симметричных молекулах: Н3С–СН3 (этан), Н2С=СН2 (этилен), НО–ОН (пероксид водорода), H2N–NH2 (гидразин).

Полярная ковалентная связь образуется между атомами различных элементов-неметаллов, отличающихся электроотрицатель- ностью. В этом случае электронная плотность молекулярной орбитали общей электронной пары смещена к более электроотрицательному атому, что приводит к появлению на нём частично отрицательного заряда δ–[9], а на другом атоме — частично положительного заряда δ+, например в молекуле НСl. Такая молекула представляет собой диполь, так как центры распределения положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии l.
 Мерой полярности ковалентной связи служит её дипольный момент μсв. = δ ∙ l, где δ – заряд полюса диполя, а l – длина диполя.
Мерой полярности ковалентной связи служит её дипольный момент μсв. = δ ∙ l, где δ – заряд полюса диполя, а l – длина диполя.
Дипольный момент – величина векторная, причём за положитель-
ное направление обычно принимают направление от δ+ к δ–.
Единицей измерения полярности связи является Дебай (Д или D):
1Д = 3,3 ∙ 10-30 Кл ∙ м.

Полярность отдельных связей равна:
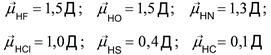
Следует различать полярность ковалентной связи и полярность молекулы. Полярность связей зависит от значений электроотрицатель-ности связанных атомов, а полярность молекулы зависит от полярности связи и от геометрии молекулы.
Для двухатомной молекулы величина дипольного момента кова- лентной связи является мера полярности молекулы в целом.
Для многоатомной молекулы дипольный момент равен векторной (геометрической) сумме дипольных моментов отдельных связей.
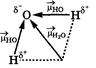
| В молекуле H2O | В молекуле CO2 |

| 
|
|

|
| Молекула воды полярна, т. к. обра- зована с помощью двух ковалент- ных полярных связей НО и имеет угловую форму. Валентный угол Н-О-Н составляет 104,5˚, поэтому у атома кислорода с частичным отрицательным зарядом δ- и двумя неподеленными электронными парами деформируется отрица- тельный полюс молекулы, а у атомов водорода с зарядом δ+ положительный. Молекула воды - диполь. | Связь в молекуле углекислого газа полярны, а молекула не полярна, т. к. имеет линейное строение. |
Молекула полярна, если содержит полярные связи и имеет несимметричную структуру, при которой центры распределения положительных и отрицательных зарядов в молекуле не совпадают.
Дипольный момент симметрично построенных молекул СО2 и SO3 равен нулю, хотя связи С=О и S=О полярны.
Значения дипольного момента как связи, так и молекулы являются важными характеристиками их реакционной способности. Как правило, чем больше полярность системы, тем выше её реакционная способность. Сильнополярная ковалентная связь под действием полярных молекул растворителя способна к гетеролитическому разрыву с образованием ионов. Например, водный раствор хлороводорода - сильная кислота, так как молекулы НС1 в воде практически полностью диссоциированы на ионы (степень диссоциации α = 0,95, или 95 %):
HCl  H+ + Cl¯
H+ + Cl¯
Вещества, молекулы которых полярны, обычно имеют более высокие температуры плавления и кипения, чем вещества с приблизительно той же молекулярной массой, молекулы которых неполярны.
Поляризуемость
Наряду с полярностью ковалентной связи или молекулы важное значение имеет понятие поляризуемость связи.
Поляризуемость ковалентной связи – это способность электронной плотности этой связи смещаться под действием внешнего электрического поля или других воздействий.

 Внешним электрическим полем для данной частицы может быть электрическое поле соседней полярной молекулы или соседнего иона. Во всех типах молекул — полярных и неполярных, а также в нейтральных атомах и ионах под действием внешнего электрического поля происходит смещение электронной плотности молекулярной или атомной орбитали, в результате возникает наведённый, или индуцированный, дипольный момент. Индуцированный диполь, хотя и существует только при наличии внешнего электрического поля, может вызывать резкое изменение реакционной способности отдельных связей и молекулы в целом. Поляризуемость ковалентной связи зависит от подвижности общей электронной пары. Так, в молекуле HI подвижность общей электронной пары, а следовательно, и поляризуемость связи значительно больше, чем в молекуле HF, и поэтому связь H–I под действием полярных молекул воды значительно легче диссоциирует на ионы, чем связь H–F. Именно поэтому кислота HI относится к сильным, а HF — к слабым кислотам, несмотря на более высокую полярность молекулы HF (μHF = 1,5 Д; μHI = 0.4 Д). Этот пример демонстрирует влияние поляризуемости ковалентной связи на её реакционную способность.
Внешним электрическим полем для данной частицы может быть электрическое поле соседней полярной молекулы или соседнего иона. Во всех типах молекул — полярных и неполярных, а также в нейтральных атомах и ионах под действием внешнего электрического поля происходит смещение электронной плотности молекулярной или атомной орбитали, в результате возникает наведённый, или индуцированный, дипольный момент. Индуцированный диполь, хотя и существует только при наличии внешнего электрического поля, может вызывать резкое изменение реакционной способности отдельных связей и молекулы в целом. Поляризуемость ковалентной связи зависит от подвижности общей электронной пары. Так, в молекуле HI подвижность общей электронной пары, а следовательно, и поляризуемость связи значительно больше, чем в молекуле HF, и поэтому связь H–I под действием полярных молекул воды значительно легче диссоциирует на ионы, чем связь H–F. Именно поэтому кислота HI относится к сильным, а HF — к слабым кислотам, несмотря на более высокую полярность молекулы HF (μHF = 1,5 Д; μHI = 0.4 Д). Этот пример демонстрирует влияние поляризуемости ковалентной связи на её реакционную способность.
С поляризуемостью связи тесно связано понятие о поляризуемости атома, молекулы или иона, то есть способности этих частиц трансформировать свои электронные оболочки под внешним воздействием.
Поляризуемость частиц прежде всего зависит от их размера и числа электронов. Чем меньше размер и число электронов у частицы, тем менее она поляризуема. Большие частицы с большим числом электронов поляризуются легче. В зависимости от способности поляризоваться атомы, молекулы или ионы подразделяют на мягкие — легкополяризуемые и жёсткие — малополяризуемые частицы.

Понятие о "жёсткости" и "мягкости" частиц важно при рассмотрении их реакционной способности. В соответствии с принципом "подобное с подобным" наиболее эффективно взаимодействуют "жёсткие" частицы с "жёсткими", а "мягкие" - с "мягкими".
ИОННАЯ СВЯЗЬ
При взаимодействии двух атомов, резко различных по электроотрицательности, общая электронная пара может быть практически полностью смещена к более электроотрицательному атому, превращая его в отрицательный ион, при этом другой атом превращается в положительный ион. Между этими ионами возникает электростатическое притяжение, то есть ионная связь.
Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром только одного из соединяемых атомов, что приводит к образованию противоположно заряженных ионов, электростатически притягивающихся друг к другу, называется ионной связью.
Ионная связь реализуется только в соединениях атомов типичных металлов с типичными неметаллами, например в CsF, KBr, NaCl, и только в твёрдом состоянии.
Электрическое поле иона имеет сферическую симметрию, вследствие чего ионная связь, в отличие от ковалентной, не обладает направленностью, а поскольку взаимодействие двух заряженных ионов не приводит к полной компенсации их полей, поэтому ионная связь не обладает насыщаемостью. Говорить о связи между каким-либо катионом и одним определённым анионом нельзя – всегда любой катион взаимодействует со всеми анионами, находящимися поблизости. Отсюда следует характерная особенность соединений с ионной связью — ассоциация.
Благодаря ассоциации ионов все соединения с ионной связью в твёрдом состоянии имеют ионную кристаллическую решётку.
В узлах ионной кристаллической решётки чередуются катионы и анионы (рис. 13). Расстояния между противоположно заряженными ионами в кристаллах меньше, чем расстояния между одноимёнными ионами, поэтому электростатические силы межионного притяжения преобладают над силами отталкивания. Однако при дальнейшеи сближении разноименных ионов начинают проявляться уже силы их отталкивания. Равенство сил притяжения и отталкивания удерживает ионы на определенном расстоянии друг от друга. Так как электростатические силы не обладают ни насыщаемостью, ни направленностью, каждый ион взаимодействует не только с ионами своего непосредственного окружения, но и со всеми другими ионами кристалла.
К числу важнейших типов ионных кристаллических решёток относятся решетки типа NaCl (рис.13 а) и решетки типа CsCl (рис. 13 б).В кристалле NaCl восемь хлорид-ионов образуют восемь вершин куба, а шесть других хлорид-ионов лежат в центрах шести граней этого куба. Таким образом, хлорид-ионы образуют кубическую гранецентрированную решётку. Меньшие по размерам катионы натрия (rС1- = 167 пм, r Na+ = 116 пм) занимают октаэдрические пустоты в решетке, образованной хлорид-ионами. Кристаллическая решётка, образованная катионами натрия, также является кубической гранецентрированной. Поэтому кристаллические решётки типа NaCl можно рассматривать как результат взаимного проникновения двух кубических гранецентрированных решёток. Так как каждый катион натрия в решётке NaCl окружен шестью хлорид-ионами, а каждый хлорид-ион окружают шесть катионов натрия, то координационные числа обоих ионов равны шести.
Радиус катиона цезия (181 пм) немного больше радиуса хлорид-иона (167 пм). В результате этого CsCl образует кристаллы другого типа, чем NaCl. И катионы цезия, и хлорид-ионы образуют кубические решётки, так что в центре куба, образованного восемью хлорид-ионами, находится катион цезия, и наоборот. Для обоих ионов в решётке хлорида цезия координационные числа равны восьми.
Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов. У натрия, например, на один валентный электрон приходится девять валентных орбиталей (3s - одна, 3p – три и 3d - пять).

Атомы натрия равномерно распределены в узлах кристаллической решетки, и при этом каждый атом имеет в ней по 8 ближайших соседей. Для образования двух центровых связей в подобной структуре атом натрия должен был бы иметь 8 электронов, что, конечно, невозможно.
Однако при сближении атомов и образовании кристаллической решётки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между атомами кристалла. Химическая связь в металлических кристаллах сильно делокализована.
Вследствие незначительного энергетического различия между соседними перекрывающимися орбиталями световые лучи не могут поглощаться, они отражаются. Ковкость и пластичность металлов также объясняются специфическими свойствами металлической связи - при механическом воздействии на твёрдое тело отдельные слои кристаллической решётки смещаются относительно друг друга. При этом происходит лишь некоторое перераспределение делокализованных электронов, связывающих друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, но не разрушается.

Рис. 13. Кристаллические решётки NaCl (a), CsCl (б)и модели взаимного расположения катионов и анионов в них
Ионный кристалл не содержит молекул, его можно считать одной громадной молекулой, так как все соседние ионы в нём связаны одинаковыми силами. Вследствие высокой полярности ионной связи и склонности ионов к ассоциации с молекулами полярных растворителей ионные соединения в воде (диэлектрическая проницаемость воды ε при 25 0С равна 78,3) легко диссоциируют на ионы, которые сразу же гидратируются в растворе, то есть образуют новые ассоциаты, называемые гидратами. Для ионных соединений характерны высокие температуры плавления и кипения; их расплавы и растворы проводят электрический ток.
Из сопоставления особенностей ионной и ковалентной связей следует, что ионную связь можно рассматривать как предельный случай сильно полярной ковалентной связи. Идеальных ионных соединений (со 100 % ионной связью) не существует, поэтому говорят о частично ионном и частично ковалентном характере связей. Так, даже связь в молекуле CsF носит частично ковалентный характер, так как электронная плотность сосредоточена у аниона фтора только на 94 %. Степень ионности (доля ионного характера) связи обычно тем выше, чем больше разность относительной электроотрицательности (ОЭО) между соединёнными атомами.
Если разность относительных электроотрицательностей взаимодействующих атомов ∆χ[10]равна 0, то образуется ковалентная неполярная связь; если 0 < ∆χ< 1,7 - ковалентная полярная; если ∆χ > 1,7 - ионная связь.
Таким образом, природа химической связи едина, и существующее различие между типами связи имеет количественный характер.
Не нашли, что искали? Воспользуйтесь поиском: