
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Индивидуальное задание №2
(Учение о химическом процессе. Основы химической термодинамики. Химическое равновесие. Основы химической кинетики.)
1. Оценить термодинамическую возможность протекания в стандартных условиях реакции:
N2(г) + 4H2O(ж) + O2(г) = 2NH4NO3(т)
Может ли эта реакция протекать при высоких температурах? Дать объяснения. Почему величину изменения энергии Гиббса DG0 можно использовать в качестве критерия самопроизвольности протекания химической реакции? Объяснить, возможны ли случаи, когда реакции с DG0<0 не идут.
2. В каких температурных условиях термодинамически возможны реакции, протекающие с уменьшением и увеличением энтальпии? Привести примеры.
3. Показать расчетами, какое из веществ, HCl(г) или HI(г), термодинамически стабильнее при 250C. Что понимают под термодинамической стабильностью?
4. Наметить общие принципы получения термодинамически стабильных веществ. Привести примеры. Какими способами можно получить нестабильные вещества, такие как O3, H2O2, Cl2O?
5. Какой смысл вкладывается в понятия внутренней энергии и энтальпии системы? Изобразить на энергетической диаграмме изменение энтальпии для следующих реакций:
N2(г) + O2(г) = 2NO(г), DH>0;
N2(г) + 3H2(г) = 2NH3(г), DH<0;
6. Записать выражение закона действующих масс для следующих равновесных систем:
2NO2  N2O4,
N2O4,
CH3COOH  CH3COO- + H+,
CH3COO- + H+,
NH4OH  NH4+ + OH-,
NH4+ + OH-,
H2O 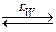 H+ + OH-,
H+ + OH-,
Cu2+ + 4NH3  [Cu(NH3)4]2+,
[Cu(NH3)4]2+,
[Cu(NH3)4]2+  Cu2+ + 4NH3,
Cu2+ + 4NH3,
Fe3+ + H2O  FeOH2+ + H+,
FeOH2+ + H+,
AgCl(т)  Ag+(р) + Cl-(р)
Ag+(р) + Cl-(р)
Назвать указанные константы равновесия.
7. При некоторой температуре равновесные концентрации в системе
2SO2 + O2 ⇄ SO3
Составляют [SO2] = 0,004 моль/л; [O2] = 0,06 моль/л; [SO3] = 0,02 моль/л. Вычислить константу равновесия и исходные концентрации диоксида серы и кислорода.
8. Как повлияет на процесс термического разложения создания вакуума в реакционном сосуде?
9. Какие экспериментальные данные требуются для определения порядка реакции?
10. Энергия активации в одном случае равна 30 кДж/моль, во втором 60 кДж/моль. Покажите, какая реакция протекает с большей скоростью при комнатной температуре. Что понимается под понятием энергия активации реакции и как ее можно определить?
11. Что называется константой скорости? Выведите ее размерность для реакций первого и второго порядков.
12. Почему с увеличением температуры возрастает скорость химической реакции, независимо от того, проходит она с поглощением или выделением тепла?
13. Что понимают под механизмом реакции? На основании реакций ионных, молекулярных, радикальных, цепных, последовательных, параллельных, моно-, би-, тримолекулярных предложите классификацию химических реакций. Приведите примеры указанных реакций.
14. Кратко сформулируйте основные положения теории активных соударений т теории активированного комплекса; теорий гомогенного и гетерогенного катализа.
15. Во сколько раз уменьшится скорость химической реакции при понижении температуры от 20 0С до -5 0С, если энергия активации составляет 104,6 кДж/моль?
16. Во сколько раз возрастает скорость реакции разложения N2O5
2N2O5(г) = 2N2O4(г) + O2(г)
при увеличении концентрации N2O5 в два раза, если известно, что реакция идет по стадиям:
N2O5 = N2O3 + O2 (медленная),
N2O3 = NO + NO2 (быстрая),
NO + N2O5 = 3 NO2 (быстрая),
2 NO2 = N2O4 (быстрая)?
17. Что подразумевается под уравнением скорости химической реакции? Как оно связано с полным уравнением?
18. Может ли при соотношении констант скоростей двух реакций k1 > k2 быть справедливым соотношение скоростей этих реакций v1 > v2? Дайте объяснение.
| <== предыдущая лекция | | | следующая лекция ==> |
| Индивидуальное задание №1 a | | | СПЕЦИАЛЬНЫЕ РАЗДЕЛЫ ХИМИИ |
Не нашли, что искали? Воспользуйтесь поиском: