
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Часть В. Выполните тестовые задания
Дополните:
1. Химический элемент − это _________________________________________
2. Магнитное квантовое число обозначают буквой ______________, принимает значения _______________, характеризует ___________________
3. В I группе (главной подгруппе 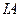 ) от лития к францию радиус атома _____, энергия ионизации ____, ОЭО _____, металлические свойства _______
) от лития к францию радиус атома _____, энергия ионизации ____, ОЭО _____, металлические свойства _______
4. Ковалентная неполярная связь встречается в молекулах, образованных _____
5. Особенности 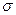 – связи: 1) _________________________________________
– связи: 1) _________________________________________
2) _________________________________________
3) _________________________________________
6. Тепловой эффект реакции – это _____________________________________
7. Стандартная теплота образования – это ______________________________
8. Принцип Ле Шателье читается так _________________________________
9. Математическое выражение Кр для реакции: СO(г) + Н2О(г) ↔ СO2 (г) + Н2 (г) имеет вид: ________________________________________________________
Укажите номер правильного ответа:
10. Четыре свободные  имеет атом:
имеет атом:
1) 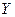 2)
2)  3)
3)  4)
4) 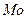
11. Электронная формула иона 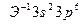 соответствует атому:
соответствует атому:
1) К 2) Ar 3) S 4) Cl
12. Атому 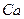 в возбужденном состоянии соответствует электронная формула:
в возбужденном состоянии соответствует электронная формула:
1) 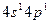 2)
2)  3)
3) 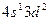 4)
4) 
13. Низшая степень окисления для элемента с электронной формулой 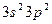 равна:
равна:
1) 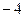 2)
2) 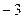 3)
3)  4)
4) 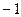
14. Вещества с ковалентной неполярной связью это:
1) водород 3) фтороводород
2) алюминий 4) вода
15.  − гибридизация в следующей частице:
− гибридизация в следующей частице:
1) 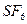 2)
2) 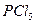 3)
3) 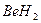 4)
4) 
16. Оксид легко разлагается при нагревании:
1) ½ О2 + Са → СаО, ∆Н= − 635,97 КДж/Моль
2) ½ О2 + 2Ag → Ag2O, ∆H= − 30,56 КДж/Моль
3) ½ O2 + Ba → BaO, ∆H= −558,51 КДж/Моль
4) ½ O2 + Fе → FеO, ∆H= − 263,68 КДж/Моль
17. Основные свойства преобладают в большей степени у оксида (подтвердите расчётами):
1) MgO (k) + CO2 (г) → MgCO3 (k)
∆G0 КДж/Моль –602,22 –394,38 –1029,3
2) ВaO + CO2 → ВaCO3
∆G0 КДж/Моль –528,4 –394,38 –1139
18. Если температурный коэффициент скорости химической реакции равен 2, то при понижении температуры от 60оС до 20оС скорость реакции _________
1) увеличивается в 16 раз 3) увеличивается в 6 раз
2) уменьшается в 8 раз 4) уменьшается в 16 раз
19. Для смещения равновесия в системе N2 (г) + О2 (г) ↔ 2NО(г) ∆Н > 0
в сторону продуктов реакции необходимо _____________________________
1) повысить давление 3) повысить температуру
2) ввести катализатор 4) уменьшить давление
20. При повышении давления в 4 раза скорость реакции СO(г)+Cl2 (г)→СOCl2(г) увеличивается
1) в 64 раза 2) в 8 раз 3) в 16 раз 4) в 12 раз
ВАРИАНТ № 2
Не нашли, что искали? Воспользуйтесь поиском: