
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Правило Клечковского.
СТРОЕНИЕ АТОМА
Развитие представлений о сложной внутренней структуре атома
Долгое время господствовало мнение, что атомы неделимы. Однако по мере накопления опытных данных, от таких представлений пришлось отказаться. В конце XIX - начале XX вв. были поставлены эксперименты, которые доказали сложность строения атомов.
В 1896 году А. Беккерель открыл явление радиоактивности. В 1898 году Мария и Пьер Кюри открыли два новых радиоактивных элемента - Ро и Ra. Было предложено, что явление радиоактивности связано с самопроизвольным распадом атомов. Так была поставлена проблема внутренней структуры атома.
Изучение прохождения электрического тока через газы и растворы позволило обнаружить одну из составных частей атома - электрон. Исследования явлений термо-, фотоэмиссии, катодных лучей (1895г. - Томсон, 1909г. - Милликен) показало, что они являются потоком отрицательно заряженных частиц, названных электронами. Так как атом в целом электронейтрален, можно представить, что это сложное образование, состоящее из электронов в области, несущей положительный заряд. В 1904 году Д. Томсон предложил первую модель строения электронейтрального атома, представляющего собой сферу, заполненную положительной материей, в которую внедрены отрицательно заряженные электроны, компенсирующие положительный заряд.
Планетарная модель атома Резерфорда
Резерфорд, изучая отклонения a-частиц, проходящих через тонкие пластинки металлов, открывает ядра атомов, что позволяет ему в 1911г предложить планетарную модель атома, по которой атом построен по аналогии с солнечной системой. Почти вся масса атома сконцентрирована в небольшом по сравнению с атомом объеме, заряженном положительно - ядре атома. Вокруг ядра вращаются электроны, число которых зависит от положительного заряда ядра.
Rядра  10-14м. Rатома 10-14м. Rатома  10-10м. 10-10м.
| 
|
1918г Резерфорд открывает протон, а в 1930г Чадвик – нейтрон.
Планетарная модель ознаменовала новый этап в изучении внутренней структуры атома, однако она не давала сведений ни о числе, ни о расположении электронов в атомах элементов, а также не могла объяснить факта устойчивости атома с позиций классической физики.
Закон Мозли
В 1912г. Мозли, изготавливая антикатод из различных тяжелых металлов, нашел зависимость между длиной волны ( ) получаемого рентгеновского луча и порядковым номером (Z) элемента.
) получаемого рентгеновского луча и порядковым номером (Z) элемента.
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов является линейной функцией атомного номера - закон Мозли.
 ,
,
 ,
,
где:  - постоянная, одинаковая для всех элементов.
- постоянная, одинаковая для всех элементов.
Порядковый номер элемента - не простая нумерация, а выражение внутреннего свойства атома – величины заряда ядра.
Итак, каждое атомное ядро характеризуется зарядом или атомным номером (Z) и массой или массовым числом (А). А - есть сумма числа протонов и нейтронов, т.е. число нуклонов.
Атомы - это наименьшие частицы химических элементов, являющиеся носителями их химических свойств. Атомы, характеризующиеся одинаковыми Z, но различными А, называют изотопами.
Атомы, содержащие одинаковое число нуклонов А, но разное число протонов Z называют изобарами.
Таблица - Основные атомные частицы и их характеристика
| Частица ↓ характеристика | протон | нейтрон | электрон | ||
| р | 
| 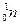
| 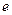
| 
| |
| заряд Z | -1 | ||||
| массовое число А | |||||
| масса, а.е.м. | 1,00728 | 1,00866 | 0,000549 | ||
| масса, кг | 1,6725∙10-27 | 1,6748∙10-27 | 9,108∙10-31 | ||
Постулаты Бора
В 1913 г. Н.Бор предложил модель атома водорода, исходя из гипотезы Резерфорда, дополненной новыми положениями:
1. Электрон вращается только по дозволенным орбитам, кинетический момент количества движения которого принимает только дискретные значения:

где: m – масса электрона;  - скорость движения электрона на орбите; r – радиус орбиты; h – постоянная Планка; n - ряд натуральных чисел.
- скорость движения электрона на орбите; r – радиус орбиты; h – постоянная Планка; n - ряд натуральных чисел.
2. Когда электрон находится на разрешенной орбите, атом энергии не излучает.
3. Атом излучает или поглощает энергию только при переходе электрона с одной орбиты на другую.
Однако теория Бора была не пригодна для объяснения строения сложных атомов.
Квантово-механические представления о строении атома
В 1900 году М. Планком было предположено, что процесс излучения световой энергии происходит порциями, квантами, энергия € которых зависит от частоты ( ) испускаемого света
) испускаемого света  (2.1); где h – постоянная Планка, h=6,62∙10-34Дж/сек.
(2.1); где h – постоянная Планка, h=6,62∙10-34Дж/сек.
В 1905 году А. Эйнштейн показал, что масса тела (m) связана с его энергией соотношением  (2.2). Следовательно,
(2.2). Следовательно,  (2.3).
(2.3).
В 1924 году Луи де Бройль предположил, что корпускулярно-волновая природа присуща не только свету, но и любым другим частицам.
Эта формула, где фигурируют  (2.4) одновременно и масса и длина волны, отражает двойственную природу электрона.
(2.4) одновременно и масса и длина волны, отражает двойственную природу электрона.
Рассмотрим частицу массой 1г, перемещающуюся со скоростью 1 м/сек. На основании формулы (2.4):  м. Следовательно, волновой характер даже атомов ускользает от нашего прямого восприятия.
м. Следовательно, волновой характер даже атомов ускользает от нашего прямого восприятия.
В 1927 году Девиссон и Джермер экспериментально обнаружили дифракцию электронов, позже волновые свойства были обнаружены для нейтронов, атомов водорода и гелия.
В волновых свойствах электрона заложен один из двух основных принципов волновой механики. Вторым является принцип неопределенности Гейзенберга (1925 г.). Он показал, что точное определение положения электрона на орбите и количество движения не могут быть точно зафиксированы. Представление об атоме с определенными орбитами электронов заменяется в волновой механике представлением об области вероятности нахождения электрона в той или иной части атома, называемой орбиталью. Оценка этой вероятности производится при решении уравнения Шредингера, описывающего волновое движение электрона. Поскольку движение электрона происходит в трехмерном пространстве, для решения уравнения Шредингера необходимы три квантовых числа:
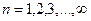 - главное квантовое число, характеризующее размер электронного облака (запас энергии электрона);
- главное квантовое число, характеризующее размер электронного облака (запас энергии электрона);
 - побочное квантовое число, определяющее форму зоны вероятности (орбитали);
- побочное квантовое число, определяющее форму зоны вероятности (орбитали);
 - магнитное квантовое число, определяющее ориентацию орбитали в магнитном поле, т.е. возможное число орбиталей на подуровне.
- магнитное квантовое число, определяющее ориентацию орбитали в магнитном поле, т.е. возможное число орбиталей на подуровне.
Позднее было введено четвертое квантовое число  , называемое спиновым, описывающее собственный момент количества движения электрона.
, называемое спиновым, описывающее собственный момент количества движения электрона.
Квантовые числа n, l, m, ms полностью характеризуют движение электрона. Два электрона, обладающие одинаковыми значениями квантовых чисел n, l, m, но разными ms (противоположные спины) обозначаются символом  , называемым квантовой ячейкой или орбиталью, заполненной двумя электронами.
, называемым квантовой ячейкой или орбиталью, заполненной двумя электронами.
Таблица – Квантовые числа, уровни, подуровни энергии и их электронная емкость
Значение главного
квантового числа 
| Обозначе- ние уровня энергии | Значение побочного
квантового числа 
| Обозначение подуровня энергии | Значение магнитного
квантового числа 
| Число орбиталей
в
подуровне 
| Число орбита-лей
в уровне 
| Электронная емкость
уровня 
|
| К | s | ||||||
| L | s p | -1, 0, +1 | |||||
| М | s p d | -1, 0, +1 -2, -1, 0, +1, +2 | |||||
| N | s p d f | -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
- Каждому значению n соответствует n2 волновых функций или орбиталей.
- Ансамбль n2 орбиталей, соответствующих данному значению n составляет уровень энергии.
-  орбиталей, соответствующих данному значению
орбиталей, соответствующих данному значению  составляют подуровень энергии.
составляют подуровень энергии.
Таблица – Орбитали слоев К, L и М

| ||||||||||||||

| ||||||||||||||

| -1 | +1 | -1 | +1 | -2 | -1 | +1 | +2 | ||||||
| символ | 1s | 2s | 2рх | 2ру | 2pz | 3s | 3рх | Зру | Зрz | 3dxy | 3dyz | 3dz2 | 3dxz | 3dx2-y2 |
Не следует терять из виду, что решение уравнения Шредингера, позволяет выразить вероятность присутствия электрона, т.е. появляется возможность представления волновой функции в форме зон вероятности или орбиталей.
Конфигурация и пространственное расположение орбиталей s, p
Орбитали состояния s ( ). Это сферы, центрированные вокруг ядра, им соответствует одна энергетическая
). Это сферы, центрированные вокруг ядра, им соответствует одна энергетическая  ячейка
ячейка

Рис. Конфигурация и пространственное
расположение s орбитали
Орбитали состояния р ( ).
).

Рис. 2. 2. Конфигурация и пространственное
расположение p орбитали
Порядок заполнения электронами энергетических уровней и подуровней
Порядок заполнения электронами энергетических уровней и подуровней подчиняется следующим правилам:
Принцип Паули.
В любой атомной или молекулярной системе не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
 - квантовая ячейка с 2мя электронами с противоположно направленными спинами.
- квантовая ячейка с 2мя электронами с противоположно направленными спинами.
 - один электрон;
- один электрон;
 - второй электрон.
- второй электрон.
Правило Хунда.
Заполнение электронных оболочек атомов происходит таким образом, чтобы суммарный спин был максимальным.
Т.е. электроны занимают сначала максимум вакантных орбиталей, при дальнейшем заполнении, в ячейках появляется по 2 электрона с противоположно направленными спинами.
Например:  (3 электрона)
(3 электрона)
 (5 электронов)
(5 электронов)
Неправильно, или
возбужденное состояние. 

Правильно, нормальное состояние 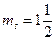

Правило Клечковского.
(Принцип наименьшей энергии)
В атоме каждый электрон стремится занять положение, соответствующее минимальному значению энергии, что отвечает наибольшей связи с ядром. Последовательность заполнения энергетических уровней и подуровней в атоме электронами происходит в соответствии с принципом наименьшей энергии. Энергия электрона определяется в основном главным квантовым числом  и побочным
и побочным  , поэтому сначала заполняются те подуровни, для которых сумма значений
, поэтому сначала заполняются те подуровни, для которых сумма значений  наименьшая. Если для двух подуровней суммы значений
наименьшая. Если для двух подуровней суммы значений  и
и  одинаковы, то сначала идет заполнение подуровня с меньшим значением
одинаковы, то сначала идет заполнение подуровня с меньшим значением  . Таким образом, заполнение энергетических уровней и подуровней происходит в следующей последовательности: 1s
. Таким образом, заполнение энергетических уровней и подуровней происходит в следующей последовательности: 1s  2s
2s  2p
2p  3s
3s  3p
3p 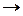 4s
4s 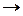 3d
3d 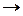 4p
4p 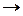 5s
5s 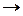 4d
4d 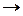 5p
5p 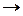 6s
6s 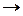 4f
4f 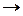 5d
5d 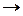 6p
6p 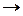 7s
7s 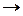 5f
5f  6d
6d  7p
7p
Электронные формулы элементов и периодическая система
Исходя из электронной емкости орбиталей, подуровней и уровней энергии (табл.3) и правила Клечковского рассмотрим связь порядка их заполнения электронами с периодической системой элементов Д.И. Менделеева. При этом следует иметь ввиду, что при создании периодической системы Д.И. Менделеев не имел представления об электронных конфигурациях атомов и тем удивительнее точное совпадение электронных представлений о строении атома с открытием Д.И. Менделеева!
Таблица - Электронные формулы элементов и периодическая система
| № периода | Внешняя электронная оболочка | Максимальное число электронов и элементов | |||
| 1s1-2 | |||||
| 2s1-2 | 2p1-6 | ||||
| 3s1-2 | 3p1-6 | ||||
| 4s1-2 | 3d1-10 | 4p1-6 | |||
| 5s1-2 | 4d1-10 | 5p1-6 | |||
| 6s1-2 | 4f1-14 | 5d1-10 | 6p1-6 | ||
| 7s1-2 | 5f1-14 | 6d1-10 | 7p? | 19… |
Примеры составления электронной формулы элемента:
Марганец
У марганца (Мn) порядковый номер 25, следовательно, заряд ядра атома +25, а так как атом - система электронейтральная, то вокруг ядра вращается 25 электронов. Элемент находится в четвертом периоде, значит энергетических уровней 4. Первый уровень состоит из одного подуровня, второй - из двух, третий - из трех, четвертый - из четырех. Марганец -элемент побочной подгруппы, следовательно, на внешнем уровне находится 2 электрона и поэтому элемент отрицательной степени окисления не имеет, высшая степень окисления равна номеру группы +7.
Электронная схема Электронная формула
| 1s2 2s2 2р6 3s2 3р6 3d5 4s2 |
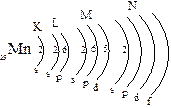
Распределение электронов по энергетическим ячейкам.
(нормальное состояние)

Хлор
Электронная схема Электронная формула
| 1s2 2s2 2р6 3s2 3р5 |
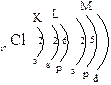
Распределение электронов по энергетическим ячейкам
(нормальное состояние)
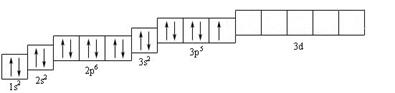
Следовательно, электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Это пространство, в котором наиболее вероятно нахождение электрона, называется орбиталью. Орбитали атома имеют разные размеры и формы. Орбитали близких размеров образуют электронные слои или энергетические уровни.
Заполнение орбиталей электронами происходит в соответствии с принципом Паули, правилом Хунда и правилом Клечковского.
Электронные формулы атомов элементов находятся в полном соответствии с расположением химических элементов в периодической системе Д.И. Менделеева.
| <== предыдущая лекция | | | следующая лекция ==> |
| Атом железа захватил лишний электрон. Заряжен ли он? | | | Электронная структура атома |
Не нашли, что искали? Воспользуйтесь поиском: