
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
до виконання домашнього завдання по дисципліні
Методичні вказівки
" Термодинаміка металургійних розплавів"
Галузь знань – 0504 " Металургія та матеріалознавство "
напрям підготовки – 6.050401 „ Металургія ”
освітньо-кваліфікаційний рівень – бакалавр
Алчевськ, 2009
1 ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ РАСКИСЛЕНИЯ МЕТАЛЛОВ
Теоретические основы
Реакцию раскисления жидкого металла раскислителем – R, можно представить следующим образом:
1/n(RmOn) = m/n[R] + [O]
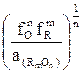 Если концентрации элементов в металле выразить через проценты по массе, то константа равновесия реакции примет вид
Если концентрации элементов в металле выразить через проценты по массе, то константа равновесия реакции примет вид
K [O], RmOn= [O] [R] m/n
Из этого уравнения выразим концентрацию кислорода
lg [O] = lgK [O], RmOn– m/n lg[R] + l/n lga(RmOn) - lgfO - m/n lgfR, (1.1)
где a(RmOn) — активность продукта раскисления в оксидном расплаве;
fO и fR – коэффициенты активности кислорода и элемента-раскислителя в металле; причем
lgfO = eOO* [О] + eOR [R]; lgfR = еRR [R] + еRO [О],
где – eOO, eOR, еRR, еRO– термодинамические массовые параметры взаимодействия кислорода и элемента-раскислителя.
Для оценочных расчетов, двумя последними членами в уравнении (1.1) можно пренебречь (вследствие малых концентраций [R] и [О]). Третий член,- отражающий связь между [O] и a(RmOn),- для большинства раскислителей также достаточно невелик (лишь для MnO следует учесть aMnO ≈ 0,2).
Задание
При заданной температуре и концентрации элементов-раскислителей в металле рассчитать равновесную концентрацию кислорода в жидком металле.
Порядок решения
1 Воспользовавшись таблицей 1, рассчитать по заданному варианту lgK [O], RmOn.
2 По уравнению (1.1) рассчитать lg [O] и [O].
3 Построить, в координатах [R] и [О] график зависимости содержания кислорода от концентрации элемента-раскислителя.
Таблица 1 Реакции раскисления жидкого железа
| R | 1/n(RmOn) = [O] + m/n[R] | lgK [O], RmOn |
| Si | 1/2 SiO2 = [O] + 1/2 [Si] | lgK [O], SiO2= - 15238/T + 5,735 |
| Mn | (MnO) = [O] + [Mn] | lgK [O], MnO= - 15200/T + 6,780 |
| Al | 1/3 Al2O3 = [O] + 2/3 [Al] | lgK [O], Al2O3= - 21263/T + 6,862 |
| Ti | 1/2 TiO2 = [O] + 1/2 [Ti] | lgK [O], ТiO2= - 15350/T + 5.17 |
Варианты задания
| № варианта | Т, К | Элемент-раскислитель | Концентрация, %, (считать через 0,1%) | № варианта | Т, К | Элемент-раскислитель | Концентрация, %, (считать через 0,1%) |
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Продолжение таблицы с вариантами задания | |||||||
| № варианта | Т, К | Элемент-раскислитель | Концентрация, %, (считать через 0,1%) | № варианта | Т, К | Элемент-раскислитель | Концентрация, %, (считать через 0,1%) |
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Si | 0,1…0,5 | Si | 0,1…0,5 | ||||
| Al | 0,1…0,3 | Al | 0,1…0,3 | ||||
| Ti | 0,1…0,3 | Ti | 0,1…0,3 | ||||
| Mn | 0,1…0,5 | Mn | 0,1…0,5 | ||||
| Ti | 0,1…0,3 | Si | 0,3…0,7 | ||||
| Al | 0,1…0,3 | Mn | 0,3…0,7 | ||||
| Al | 0,1…0,3 | Si | 0,3…0,7 | ||||
| Mn | 0,1…0,5 | Mn | 0,3…0,7 |
2 КИСЛОРОД И МАРГАНЕЦ В ЖИДКОМ ЖЕЛЕЗЕ
Теоретические основы
Кислород имеет ограниченную растворимость в жидком железе, которая описывается уравнением
lg [O]max = -6320/T + 2,734 (2.1)
Раствор кислорода в жидком железе показывает небольшие отрицательные отклонения от закона Генри. Температурную зависимость коэффициента активности кислорода fO можно представить уравнением
lg fO = (-1750/T + 0,76)∙[O]. (2.2)
Марганец присутствует в чугуне и в стали. Концентрация и активность кислорода, растворенного в жидком железе, понижаются при введении в расплав третьего элемента, например марганца, имеющего повышенное сродство к кислороду по сравнению с железом. Продуктом взаимодействия является МnО, выделяющийся в оксидную фазу:
[Мn] + [ О] = (МnО), ΔG° = -290720 +129,66 Т, Дж; (2.3)
lgK = lg  (2.4)
(2.4)
В трехкомпонентной системе Fe - Mn - О в равновесии с жидким железом (раствором кислорода и марганца в жидком железе) шлак может быть одно фазным (жидким или твердым) или двухфазным (жидкость + твердое). Если задана температура, то можно определить равновесный состав всех трех фаз: (FeO — МnО), < FeO — МnО> и [ Fe, Мn, О]. Равновесные составы металла (концентрации кислорода и марганца в жидком железе) и оксидных фаз можно рассчитать, пользуясь следующим уравнением:
[ Fe] + [ О] = (FeO), ΔG0 = -122680 + 52,43 T, Дж; (2.5)
Задание
При заданной температуре рассчитать растворимость кислорода в жидком железе. Рассчитать концентрацию марганца в жидком железе, содержащем 0,1% кислорода, при которой возникает оксидная фаза из МnО и FeO. Рассчитать состав этой оксидной фазы (шлака).
Порядок решения
4 По уравнению (2.1) рассчитать растворимость кислорода в жидком железе.
5 По уравнению (2.5) рассчитать ΔG0.
6 Воспользовавшись уранением ΔG0 = -RT lnK, найти К.
7 С другой стороны,
К =  , так как a[Fe] ≈ 1, тогда а(FeO) = а[O]∙K.
, так как a[Fe] ≈ 1, тогда а(FeO) = а[O]∙K.
Для расчета а(FeO) нужно определить а[O]. Известно, что активность кислорода равна
а[O] = fO∙[O], где fO можно найти из (2.2). После этого находим а(FeO)
8 Для идеальных растворов а(FeO) = N(FeO). Шлак представляем двухкомпонентным идеальным раствором: N(FeO) + N(MnO) = 1. Из этого равенства определим N(MnO).= а(MnO).
9 По уравнению (2.3) найдем ΔG0, далее так же, как и в п.3 найдем К для реакции окисления марганца.
10 Из (2.4) определяем [Mn], приняв f[Mn] = 1, так как раствор марганца в железе близок к идеальному.
Варианты задания
| № варианта | Т, К | № варианта | Т, К | № варианта | Т, К |
| <== предыдущая лекция | | | следующая лекция ==> |
| Учимся жить и любить снова | | | Правила Переноса слов |
Не нашли, что искали? Воспользуйтесь поиском: