
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
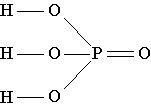
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства:
| Свойства, общие с другими кислотами | Специфические свойства |
| 1. Водный раствор кислоты изменяет окраску индикаторов на красный: Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4-(дигидроортофосфат-ион) H2PO4- ↔ H+ + HPO42-(гидроортофосфат-ион) HPO42- ↔ H+ + PO43-(ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4+ H2O или H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. Реагирует с солями слабых кислот: 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ | 1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2H3PO4 (t˚C) → H2O + H4P2O7 H4P2O7 (t˚C) → H2O + 2HPO3 2. Качественная реакция наPO43- - фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов. |
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·CaF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Не нашли, что искали? Воспользуйтесь поиском: