
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Типи розрахункових задач.
2.1. Обчислення масової частки елемента в складі речовини за її хімічною формулою
Обчислити масову частку елемента в складі речовини за її формулою означає встановити, яка частина складної речовини припадає на частку кожною елемента.

де n — число атомів даного елемента у формулі речовини;
Е — елемент;
w — масова частка елемента.
Загальна формула для визначення масової частки елемента або сполуки в речовині:

Задача 1. У складі речовини містяться Кальцій — 29,4%; Сульфур — 23,5% і Оксиген — 47,1%. Визначте формулу цієї сполуки.
 Дано: Розв’язання
Дано: Розв’язання
1. За умовою задачі речовина містить у складі атоми Кальцію, Сульфуру й Оксигену, але кількість атомів кожного елемента невідома, тому їхнє число позначимо х, у, z. Приймемо загальну
масу речовини СаxSyОz такою, що дорівнює 100 г. Тоді, виходячи з формули (2), виводимо формулу для визначення маси речовини:


2. Обчислюємо маси Кальцію, Сульфуру, Оксигену:



3. Щоб визначити число атомів елемента у формулі, треба масу цього елемента розділити на його відносну атомну масу. Часто використовують таку форму запису:

де х, у, z — індекси у формулі, а 40, 32 і 16 — відносні атомні маси відповідно Кальцію, Сульфуру й Оксигену. У результаті ділення одержуємо округлені числа: х: у: z = 0,735: 0,734: 2,9.
4. Індекси прийнято записувати як цілі числа, тому, для того щоб перейти до цілочисельних значень, обчислені результати ділимо на найменший із них, тобто на 0,734, й одержуємо округлені числа:

Отже, до складу речовини входить 1 атом Кальцію, 1 атом Сульфуру й 4 атоми Оксигену.
Відповідь: формула речовини СаSO4.
Задача 2. Визначити масову частку елементів в алюміній оксиді Al2O3.
 Дано: Розв’язання
Дано: Розв’язання
1. Визначаємо Mr (Al2O3):
Mr (Al2O3) = 2 Аr (Al) + 3 Аr (O) = 2•27 + 3•16 = 102
2. Обчислюємо w (Al) в сполуці:

3. Знаходимо w (О) в сполуці:

Відповідь: w (Al) в сполуці Al2O3 дорівнює 0,53, або 53%, w (О) — 0,47, або 47%.
Задачі для самостійного розв’язування
1. Обчисліть масову частку кожного елемента в кальцій карбонаті СаСО3.
2. Обчисліть масову частку кожного елемента в сульфатній кислоті.
3. Обчисліть масову частку (у %) кожного елемента в кальцій гідроксиді.
2.2. Обчислення числа атомів (молекул) у певній кількості речовини
Обчислення здійснюються за формулою:

де NА — стала Авогадро — 6,02 • 1023 моль-1; n — кількість речовини (моль); N — число атомів чи молекул.
Пам’ятайте: 1 моль речовини містить NА частинок.
Задача. Обчисліть, скільки молекул води міститься в 5 моль цієї речовини.
 Дано: Розв’язання
Дано: Розв’язання
І спосіб.
Із формули (3) маємо: N = NA • n.
N (Н2О)=6,02•1023моль-1•5моль = 3,1 • 1024.
ІІ спосіб.
1 моль — NA молекул;
5 моль — N молекул;
N (Н2О) = 5 моль • 6,02 • 1023моль-1 = 3,1 • 1024.
Відповідь: У воді кількістю речовини 5 моль міститься 3,1 • 1024 молекул цієї речовини.
Задачі для самостійного розв’язування
1. Скільки молекул аміаку NH3 міститься в 10 моль цієї речовини?
2. Обчисліть масу 1,5 моль сульфідної кислоти H2S.
3. Скільки молекул метану СН4 міститься в 3,3 моль цієї речовини?
2.3. Обчислення маси речовини за відомою кількістю і кількості речовини за відомою масою
Обчислення здійснюють, виходячи з формули:

де M — молярна маса речовини (г/моль); m — маса речовини (г, кг, т); n — кількість речовини (моль).
Задача. Обчисліть масу ферум (III) оксиду, узятого в кількості речовини 5 моль.
 Дано: Розв’язання
Дано: Розв’язання
Із формули (4) маємо: m = M • n.
Знаходимо масу 5 моль ферум 23 (ІІІ) оксиду:
m (Fe2О3) = M (Fe2О3) • n (Fe2О3) = 160 г/моль • 5 моль = 800 г.
Відповідь: маса 5 моль ферум (III) оксиду дорівнює 800 г.
Задачі для самостійного розв’язування
1. Визначте молярну масу речовин: а) кальцій оксиду СаО; б) натрій оксиду Na2O; в) алюміній хлориду АlС13.
2. Визначте молярну масу речовини, якщо відомо, що: а) 7 моль її мають масу 448 г; б) 3,5 моль її мають масу 84 г; в) 0,25 моль її мають масу 8 г.
3. Визначте масу натрій карбонату кількістю речовини 0,25 моль.
2.4. Обчислення маси, об’єму та кількості речовини за рівнянням реакції
Алгоритм розв’язування:
1. Короткий запис умови задачі.
2. Запис рівняння реакції, розстановка коефіцієнтів, перевірка правильності запису.
3. Запис над формулами речовин даних з умови задачі.
4. Запис під формулами речовин даних з рівняння реакції.
5. Перевірка розмірності одиниць над формулами та під формулами речовин, яка має бути однаковою.
6. Складання пропорції і здійснення обчислень.
Задача. Яка маса фосфору та який об’єм кисню витратяться на утворення 4 моль фосфор (V) оксиду?
 Дано: Розв’язання
Дано: Розв’язання
Хг Yл 4моль
4Р + 5О2 = 2Р2О5
n =4моль n =5моль n =2моль
m=4•31г V=5•22,4л
1. Визначаємо масу фосфору, яка витратиться на утворення 4
моль Р2О5.

2. Обчислюємо об’єм кисню.

Відповідь: m (Р) = 248 г, V (O 2) = 224 л.
Задачі для самостійного розв’язування
1. Який об’єм H2 виділиться внаслідок взаємодії магнію масою 4,8 г з HCl?
2. Яка маса алюміній оксиду утвориться в результаті окиснення 0,2 моль алюмінію?
3. Яка кількість речовини метану (СН4) утвориться під час взаємодії 224 л водню з вуглецем?
2.5. Обчислення, пов’язані з молярним об’ємом
Молярний об’єм Vm дорівнює відношенню об’єму газу до його кількості:

За нормальних умов Vm = 22,4 л/моль для будь якого газу.

Задача. Обчисліть об’єм кисню (за н.у.), узятого в кількості 0,2 моль.
 Дано: Розв’язання
Дано: Розв’язання
Із формули (5) маємо:
V = Vm • n.
Знаходимо об’єм 0,2 моль 2 кисню:
V (О2) = Vm • n (О2); V (О2) = 22,4 • 0,2 = 4,48 л.
Відповідь: V (О2) = 4,48 л.
Задачі для самостійного розв’язування
1. Який об’єм займе водень кількістю речовини 10 моль?
2. Обчисліть об’єм вуглекислого газу СО2, узятого в кількості 5,5 моль.
3. Яку кількість речовини становлять 448 л метану СН4?
2.6. Обчислення, пов’язані з відносною густиною газів
Відносна густина газу D — це величина, яка дорівнює відношенню маси певного об’єму одного газу до маси такого самого об’єму іншого газу за однакових умов.

Відношення мас рівних об’ємів газів за однакових умов дорівнює відношенню їх молярних (відносних молекулярних) мас.

M r (повітря) = 29.
Задача 1. Обчисліть відносну густину сульфур (IV) оксиду за воднем і повітрям.
 Дано: Розв’язання
Дано: Розв’язання
1. Знаходимо відносну густину сульфур (IV) оксиду за воднем.

2. Яка відносна густина сульфур (IV) оксиду за повітрям?

Відповідь: DН2 (SО2) = 32, D(пов.) (SО2) = 2,2.
Задача 2. Маса газоподібної сполуки об’ємом 1 л (н. у.) дорівнює 1,52 г. Знайдіть молярну масу газу і його густину за воднем.
 Дано: Розв’язання
Дано: Розв’язання
1. Знаючи масу газу об’ємом 1 л (н. у.), обчислюємо його молярну масу за формулою (6):

2. Визначаємо густину газу за воднем за формулою 

Відповідь: молярна маса газу дорівнює 34 г/моль; густина за воднем дорівнює 17.
Задачі для самостійного розв’язування
1. Густина газу за воднем дорівнює 17. Визначте молярну масу газу.
2. Обчисліть густину за гелієм: а) азоту; б) кисню; в) амоніаку; г) метану.
3. Визначте відносну густину за воднем і за повітрям карбон(ІУ) оксиду.
2.7. Обчислення на застосування закону об’ємних відношень газів
Об’єми газів, що вступають у реакцію, і газоподібних продуктів реакції відносяться між собою як коефіцієнти в рівнянні реакції. Коефіцієнти в рівнянні реакції перед формулами газоподібних речовин вказують не тільки на кількість речовин, а й на їх об’єми.
Задача 1. Який об’єм аміаку NН3 утвориться внаслідок взаємодії з воднем 20 л азоту?
 Дано: Розв’язання
Дано: Розв’язання
Обчислюємо об’єм аміаку, що утворюється.

Відповідь: Об’єм аміаку, що утворюється, дорівнює 40л.
Задача 2. До сульфур (IV) оксиду масою 3,2 г додали кисень масою 2,4 г. Обчисліть об’ємну частку (за н. у.) сульфур (ІV) оксиду в одержаній газовій суміші.
 Дано: Розв’язання
Дано: Розв’язання
1. Визначаємо кількість речовини сульфур (ІV) оксиду:

2. Визначаємо кількість речовини кисню:

3. Обчислюємо об’єм сульфур (ІV) оксиду й кисню за формулою V = n • Vm:
V (SO 2) = 0,05моль • 22,4л/моль = 1,12л;
V (O 2) = 0,075моль • 22,4л/моль = 1,68л.
4. Обчислюємо загальний об’єм суміші:
V заг = 1,12л + 1,68л = 2,8л.
5. Обчислюємо об’ємну частку сульфур (ІV) оксиду в одержаній газовій суміші за формулою  :
:

Відповідь: об’ємна частка (за н. у.) сульфур (ІV) оксиду в одержаній газовій суміші дорівнює 0,4 (40%).
Задачі для самостійного розв’язування
1. Який об’єм водню прореагує з 10 л хлору? Який об’єм хлороводню при цьому утвориться?
2. Який об’єм водню витратиться на реакцію з 40 л кисню?
3. Який об’єм кисню потрібний для спалювання 1 л метану (СН4)?
2.8. Обчислення за термохімічними рівняннями реакцій
Екзотермічні реакції — реакції, що проходять з виділенням тепла (+Q — тепловий ефект реакції, -  H0 — стандартна ентальпія реакції).
H0 — стандартна ентальпія реакції).
Ендотермічні реакції — реакції, що проходять з поглинанням тепла (-Q — тепловий ефект реакції, +  Н — стандартна ентальпія реакції).
Н — стандартна ентальпія реакції).
Термохімічне рівняння — це рівняння, у якому вказується тепловий ефект, або стандартна ентальпія реакції.
Задача. Яка кількість тепла виділиться внаслідок згоряння 500 г вугілля, якщо термохімічне рівняння цієї реакції таке: С+О2=СО2;  Н= -402 кДж.
Н= -402 кДж.
 Дано: Розв’язання
Дано: Розв’язання
500г Х кДж
С + О2 = СО2;  Н = -402кДж.
Н = -402кДж.
n =1моль
1 m =12г


Відповідь: Q1 = -16750 кДж.
Задачі для самостійного розв’язування
1. Унаслідок розкладу кальцій карбонату масою 25 г поглинулося 45 кДж тепла. Складіть термохімічне рівняння реакції розкладу кальцій карбонату.
2. Складіть термохімічне рівняння горіння метану в кисні, якщо відомо, що в результаті згоряння 112 л метану СН4 виділяється 4400 кДж тепла.
3. Унаслідок розкладу 2 моль кальцій карбонату поглинається 356 кДж теплоти. Напишіть термохімічне рівняння даної реакції.
2.9. Обчислення з використанням понять, пов’язаних з розчинами
Розчин складається з розчиненої речовини та розчинника:
m (розчину) = m (розчин.речовини) + m (розчинника).
Масова частка розчиненої речовини — відношення маси розчиненої m речовини до загальної маси розчину: 
Оскільки  .
.
Задача. Яку масу солі натрій хлориду необхідно взяти для приготування 300г 10-відсоткового розчину?
 Дано: Розв’язання
Дано: Розв’язання


Обчислюємо масу натрій хлориду, яку необхідно взяти.

Відповідь: m (NaCl) = 30 (г).
Задачі для самостійного розв’язування
1. У воді масою 88 г розчинили 12г солі NaCl. Обчисліть масову частку солі в отриманому розчині.
2. Яку масу 10-відсоткового розчину солі можна отримати, якщо є 40 г солі?
3. Який об’єм водню виділиться внаслідок взаємодії 98 г 20-відсоткового розчину сульфатної кислоти з магнієм?
2.10. Розв’язування задач на домішки
Домішки не вступають в реакцію і не дають продукту реакції. Масова частка домішок w (дом) обчислюється за формулою:

Об’ємна частка домішок:

Задача. Обчисліть масу кальцій оксиду, яку можна одержати внаслідок термічного розкладу вапняку масою 500 г, який містить 8 % домішок.
 Дано: Розв’язання
Дано: Розв’язання
1. Обчислюємо масу кальцій карбонату в 500 г вапняку.


m (CaCO3) = m (вапн.) - m (дом.) = 500г - 40г = 460г.
2. Знаходимо масу кальцій оксиду, яка утвориться в результаті реакції.
460 г X г
СаСO3 = СаО + СO2.
n =1моль n =1моль
m =100г m =56г

Відповідь: m (CaO) = 257,6г.
Задачі для самостійного розв’язування
1. Який об’єм водню виділиться внаслідок взаємодії розчину сульфатної кислоти з алюмінієм масою 12г, масова частка домішок у якому 10%?
2. Який об’єм кисню витратиться на спалювання сірки масою 10 г, масова частка домішок у якій становить 4%?
3. Який об’єм кисню витратиться на окиснсння сульфур (IV) оксиду об’ємом 27 л, об’ємна частка домішок у якому 20%?
2.11. Обчислення, пов’язані з масовою та об’ємною частками виходу продукту реакцій
За рівнянням реакції обчислюється лише теоретичний вихід. Практичний вихід завжди менший від теоретичного через неповний перебіг реакції та втрати. Вихід продукту обчислюється за формулами:
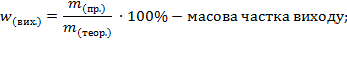

Задача. Під час нагрівання калій нітрату масою 30,3 г зібрали 3 л кисню. Обчисліть об’ємну частку виходу.
 Дано: Розв’язання
Дано: Розв’язання
1. Обчислюємо об’єм кисню, який може віділитися теоретично:
30,3 г X л
2KNO3 = 2KNO2 + O2.
n =2моль n =1моль
m =2•101г V =22,4л

2. Знаходимо об’ємну частку виходу кисню.

Відповідь:  (O 2) = 89,2%.
(O 2) = 89,2%.
Задачі для самостійного розв’язування
1. З азоту масою 56 кг було синтезовано аміак масою 48 кг. Знайдіть масову частку виходу аміаку від теоретично можливого.
2. Який об’єм аміаку можна синтезувати з азоту масою 112 кг, якщо об’ємна частка виходу аміаку становить 90 % від теоретичного?
3. Який об’єм водню витратиться на добування аміаку масою 70 г, що становить 78 % від теоретично можливого?
2.12. Обчислення за хімічним рівнянням, якщо одна з реагуючих речовин дана в надлишку
Алгоритм розв’язку задач за цим способом:
1. Записуємо скорочену умову задачі.
2. Визначаємо речовину, яка перебуває в недостачі, обчислюємо кількості вихідних речовин за умовою задачі.
3. Записуємо хімічне рівняння реакції, складаємо мольні відношення вихідних речовин та порівнюємо отримані результати.
4. Розрахунки проводимо за речовиною, що перебуває в недостачі.
Задача. Обчисліть об’єм водню, що утвориться в результаті взаємодії цинку масою 13 г із сульфатною кислотою масою 20 г.
 Дано: Розв’язання
Дано: Розв’язання
13 г 20г X л
Zn + H2SO4 = ZnSO4 + H2
n =1моль n =1моль n =1моль
m =65г m =98г V =22,4л
1. Знаходимо вихідну речовину. Позначаємо одну з відомих величин через Y. Нехай m (H2SO4) = Y (г).

Оскільки з 13 г Zn може повністю прореагувати 19,4 г H2SO4, то кислота дана в надлишку, цинк — у недостачі, а отже, є вихідною речовиною.
2. Визначаємо, який об’єм водню виділиться.

Відповідь: V (H2) = 4,48(л).
Задачі для самостійного розв’язування
1. До розчину, що містить натрій ортофосфат масою 20 г, додали кальцій хлорид масою 22,2 г. Яка маса осаду утвориться при цьому?
2. Яку масу сульфур діоксиду можна одержати із сірки масою 10 г і кисню об’ємом 5,6 л (н.у.)?
3. Яку масу алюміній сульфіду можна одержати під час сплавлення 8,1 г алюмінію з 9,6 г сірки? Яка речовина і з якою масою не прореагує?
2.13. Знаходження молекулярної формули газоподібної речовини за масовими частками елементів і відносною густиною за іншим газом
Вивести формулу — це встановити якісний та кількісний склад речовини. Виведення молекулярної формули органічної речовини здійснюється з формулами:




Алгоритм розв’язку задач за цим способом:
1. Записуємо скорочену умову задачі.
2. Знаходимо відносну молекулярну масу за відомою густиною за іншим газом, використавши формули 7, 8.
3. За формулами 9, 10 визначаємо кількість атомів елементів, що є в сполуці.
Задача. Виведіть формулу газоподібної речовини, у якій масова частка карбону дорівнює 0,83, масова частка Гідрогену— 0,17, а густина речовини за воднем — 29.
 Дано: Розв’язання
Дано: Розв’язання
1. Знаходимо відносну молекулярну масу сполуки.

M r(CxHy) = D Н2(CxHy) • M r(H2) = 29 • 2 = 58.
2. Встановлюємо кількість атомів Карбону в сполуці.


3. Знаходимо кількість атомів Гідрогену в сполуці.


Відповідь: формула сполуки – C4H10.
Задачі для самостійного розв’язування
1. Знайдіть молекулярну формулу вуглеводню, масова частка Карбону в якому 82 %, Гідрогену 18 %, якщо відносна густина його за воднем дорівнює 22.
2. Масова частка Нітрогену в одному з його оксидів дорівнює 0,26. Знайдіть формулу оксиду, якщо його відносна молекулярна маса дорівнює 108.
3. До складу хімічної речовини входять Кальцій — 29,4%, Сульфур — 23,5% і Оксиген — 47,1%. Визначте формулу цієї сполуки.
2.14. Встановлення молекулярної формули речовини за продуктами згоряння
До складу молекули може входити тільки ціле число атомів кожного елемента. Алгоритм розв’язку задач за цим способом:
1. Знаходимо молярну масу за відносною густиною.
2. Знаходимо маси елементів у продуктах згоряння: Н — Н2О, С — СО2.
3. Додаємо знайдені маси елементів, якщо сума не відповідає масі, даній в умові задачі, значить до складу речовини входить ще атоми Оксигену. Знаходимо їх через різницю мас.
4. Знаходимо масові частки елементів через відношення маси елементу до маси всієї речовини.
5. Знаходимо кількість атомів елементів через відому масову частку.
Задача. Унаслідок спалювання вуглеводню масою 4,4 г утворилися вуглекислий газ об’ємом 6,72л та вода масою 7,2 г. Виведіть формулу вуглеводню, якщо його густина за повітрям дорівнює 1,517.
 Дано: Розв’язання
Дано: Розв’язання
1.Знаходимо молярну масу вуглеводню.
M (CxHy) = D (пов.)(CxHy) • M (пов.);
M (CxHy) = 1,517 • 29 = 44г/моль.
2. Встановлюємо кількість атомів Карбону у вуглеводні.
4,4 г 6,72л 7,2г
CxHy + O2 = Х СO2 + Y / 2Н2О;
m =44г Х =22,4л 9 Y г

3. Обчислюємо кількість атомів Гідрогену в молекулі вуглеводню.

Відповідь: формула сполуки - C3H8.
Задачі для самостійного розв’язування
1. Унаслідок спалювання 9,2 г органічної речовини утворилося 17,6 г вуглекислого газу і 10,8 г води. Відносна густина цієї речовини за воднем дорівнює 23. Встановіть молекулярну формулу речовини.
2. Унаслідок спалювання 3 г органічної речовини утворилося 8,8 г вуглекислого газу і 5,4 г води. Відносна густина речовини за воднем дорівнюс 15. Встановіть формулу речовини.
3. Унаслідок спалювання 11,2 л вуглеводню утворилося 33,6 л карбон (IV) оксиду та 27 г води. Визначте формулу сполуки.
4.* На спалювання 150 л невідомої органічної сполуки витратили 900 л кисню. При цьому утворилося 600 л карбон (IV) оксиду та водяної пари. Визначте формулу речовини.
5.* Унаслідок спалювання органічної речовини масою 4,2 г утворилося 13,2 г вуглекислого газу і 5,4 г води. Відносна густина за повітрям — 2,9. Встановіть формулу речовини.
Висновки
Розрахункові задачі посідають особливе місце у вивченні хімії. Систематичне їх розв’язування сприяє засвоєнню хімічних знань, формуванню логічного мислення, розвитку розумової діяльності, навчає практичному використанню набутих теоретичних знань про хімічні поняття та закони.
Розрахункові задачі можна використовувати на всіх етапах навчального процесу: при вивченні нового матеріалу, при його засвоєнні, а також при перевірці та контролі знань учнів. Задачі відіграють значну роль в організації пошукових ситуацій, необхідних при проблемному навчанні.
У методичній розробці подано задачі всіх типів, що передбачено шкільними програмами з хімії. На початку розгляду нового типу задач коротко подається теоретичний матеріал або алгоритми розв’язування задач. Методична розробка може бути використана учителем хімії при проведенні уроків, додаткових занять, факультативів, у підготовці обдарованих школярів до ЗНО, участі в олімпіадних змаганнях.
Розв’язування задач сприяє виробленню вмінь і навичок проводити розрахунки. Це важливий засіб розвитку мислення учнів. Розробка також стане в пригоді школярам, які хочуть перевірити рівень засвоєння базових знань, навчитися застосовувати їх під час розв’язування не лише типових, а й ускладнених задач.
| <== предыдущая лекция | | | следующая лекция ==> |
| Основнымв философии традиционно считается вопрос об отношении мышления к бытию, а бытия - к мышлению (сознанию). | | | ДОРЕВОЛЮЦИОННАЯ РУССКАЯ ФИЛОСОФИЯ ПРАВА |
Не нашли, что искали? Воспользуйтесь поиском: