
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристика d-элементов VI группы
Побочная подгруппа VI группы представлена следующими элементами: Сr, Mo и W. Все они являются d-элементами, так как у них застраивается электронами d-подуровень предвнешнего уровня. Валентными электронами этих элементов являются электроны внешнего S-подуровня и предвнешнего d-подуровня ‑ всего 6 электронов.
Электронная конфигурация внешнего уровня и предвнешнего d-подуровня: Сr – 3d54S1; Мо – 4d55S1; W – 5d46S2.
d–элементы 6 группы занимают 4 место в своей декаде d–элементов, поэтому d–подуровень должен содержать 4 электрона, а на внешнем уровне должны находиться два s–электрона, как это и наблюдается для вольфрама. Для хрома и молибдена имеет место «проскок» одного s–электрона с внешнего уровня на предвнешний d–подуровень, в результате чего каждая d-орбиталь будет занята одним электроном, что соответствует наиболее устойчивому состоянию атома.
│↑│↑│↑│↑│ │ (n –1)d → │↑│↑│↑│↑│↑│ (n – 1)d
nS│↑↓│ nS │↑│
Параметры атомов d-элементов VI группы представлены в таблице 11.1.
Таблица 11.1 – Основные параметры атомов элементов VI группы
| Радиус атома rа, нм | Радиус иона r Э6+, нм | Е Эо → Э+, эВ | Ar | |
| Сr | 0,127 | 0,035 | 6,76 | |
| Mo | 0,137 | 0,065 | 7,10 | |
| W | 0,140 | 0,065 | 7,98 |
Анализируя эти данные, можно сказать, что наблюдается общая для всех d-элементов закономерность: радиусы атомов сверху вниз в подгруппе увеличиваются, но незначительно. Поскольку масса атомов в том же ряду сильно возрастает, то это приводит к уплотнению электронных оболочек у молибдена и особенно у вольфрама. Вырвать электрон из такой уплотненной структуры труднее, поэтому энергия ионизации при переходе от хрома к вольфраму возрастает, вследствие чего химическая активность элементов сверху вниз в подгруппе уменьшается. Ввиду того, что молибден и вольфрам имеют примерно одинаковый атомный и ионный радиусы, по свойствам они ближе друг к другу, чем к хрому.
В соединениях хром и его аналоги проявляют степени окисления (С.О.) 0, +1, +2, +3, +4, +5 и +6. Максимальная С.О. соответствует числу валентных электронов. Характерные С.О. хрома +3 и в меньшей мере +6 и +2. У молибдена и вольфрама, как и у других 4d- и 5d-элементов, наиболее характерна высшая С.О., то есть +6. Таким образом, для элементов подгруппы Cr наблюдается общая для d-элементов закономерность: повышение в группе сверху вниз устойчивой С.О. Поэтому окислительная способность соединений, где элементы проявляют высшую С.О., равную +6, сверху вниз в подгруппе уменьшается, так как устойчивость соединений в этом ряду увеличивается. Например, в ряду кислот:
Н2СrO4 ↓ устойчивость Cr+6 ↑ окислительная способность
Н2МоО4 ↑увеличивается Мо+6 ↓ уменьшается
Н2WО4 ↓ уменьшает W+6 ↓ уменьшает
Для Cr, Mo, W наиболее типичны координационные числа 6 и 4. Известны также производные, в которых к.ч. Мо и W достигает 8.
Примеры: [Cr(OH)4]-;[Cr(H2O)6]3+ ; [MoF6]3-; [MoF8]2-; [WF8]2-
При этом в образовании связей могут участвовать d-орбитали предвнешнего уровня, а также s- и р-орбитали внешнего уровня.
Характер связи элементов подгруппы Сr в соединениях определяется во многом С.О. элемента. Для Cr, Mo, W при низких С.О. (+1, +2) характерны ионные связи, а при высоких С.О. – ковалентные связи. В соответствии с этим Сr+2О – основной оксид, Сr2+3О3 – амфотерный, а Сr+6О3 – кислотный. Аналогично Сr(OH)2 – основание, Сr(OH)3 – амфотерный гидроксид, Н2СrО4 – кислота.
Содержание хрома в земной коре составляет 0,02% (масс), молибдена – 10-3% (масс), вольфрама – 7 ∙ 10-3% (масс). Основной рудой хрома является хромистый железняк Fe(CrO2)2 (хромит). Молибден встречается в виде минерала молибденита МоS2 (молибденовый блеск), а также молибдатов: РвМоО4 (вульфенит) и МgMoO4. Важнейшие вольфрамовые руды – вольфрамит (смесь FeWO4 и МnWO4), шеелит
СаWO4 и стольцит РвWO4.
Для получения чистого хрома сначала получают оксид Cr2O3, который затем восстанавливают алюмотермическим способом:
Cr2O3 + 2Al 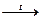 Al2O3 + 2Cr.
Al2O3 + 2Cr.
Для целей металлургии хром получают в виде сплава с железом (феррохром). Для этого хромистый железняк восстанавливают углем в электрической печи:
Fe(CrO2)2 + 4C 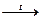 Fe + 2Cr + 4CO.
Fe + 2Cr + 4CO.
Молибден и вольфрам получают, переводя перечисленные выше минералы в оксиды, из которых металл восстанавливают водородом при высоких температурах:
2МоS2 + 7O2 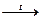 2MoO3 + 4SO2;
2MoO3 + 4SO2;
MoO3 + 3H2 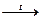 Mo + 3H2O.
Mo + 3H2O.
В виде простых веществ хром, молибден и вольфрам – серовато-белые блестящие металлы. Все они тугоплавки, а вольфрам является самым тугоплавким из металлов (Т пл.= 3380оС).
Электропроводность металлов при переходе от хрома к вольфраму в целом увеличивается и составляет для молибдена и вольфрама приблизительно 30% электропроводности серебра. На свойства металлов в большой степени влияют примеси. Так, технический хром – один из самых твердых металлов, в то время как чистый хром пластичен.
Как и тантал, ниобий совершенно не вызывает раздражения тканей человеческого тела, срастается с ними и остается инертным даже после длительного воздействия жидкой среды организма. Высокая коррозионная стойкость ниобия позволила использовать его в медицине. Ниобиевые нити не вызывают раздражения живой ткани и хорошо сращиваются с ней. Восстановительная хирургия успешно использует такие нити для сшивания порванных сухожилий, кровеносных сосудов и даже нервов.
Соединения ниобия ядовиты. Предельно допустимая концентрация ниобия в воде 0,01 мг/л.
Титан в медицине.
Конструкторов медицинской техники, медицинского инструментария и врачей разных профессий в новом конструкционном металле привлекают прежде всего биологическая инертность по отношению к организму живого существа в сочетании с высокими механическими свойствами, антикоррозионной стойкостью, а также дешевизна и доступность. Эти качества титана, усиленные специфическими свойствами, и обеспечили очень большой интерес к нему и интенсивное проведение конструкторских работ и клинических испытаний самых различных изделий. Известно, что по коррозионной стойкости во многих медицинских агрессивных средах титан не уступает платине; он стоек в растворах кислот и щелочей. Скорость коррозии титана в морской воде (по своему химическому составу очень похожей на лимфу) — 0,00002 мм/год или 0,02 мм в 1000 лет. Титан и его сплавы устойчивы и перекиси водорода, бензине, феноле, формальдегиде. После многократной стерилизации кипячением и обработки в автоклаве, многомесячной выдержки в 3%-ном растворе хлорамина, 96-градусиом этиловом спирте, растворе сулемы, трихлорэтилене следов коррозии на титановых сплавах не обнаружено. Точечная коррозия наблюдается у титановых сплавов лишь после пребывания в течение нескольких суток в 10%-ной спиртовой настойке йода.
Титан и его сплавы обладают высокой усталостной прочностью при знакопеременных нагрузках, что очень важно при изготовлении внутрикостных фиксаторов, наружных и внутренних протезов, которые постоянно подвергаются переменным нагрузкам.
Титан — пластичный металл; он хорошо поддается механической обработке: резанию, сверлению, фрезерованию, шлифованию. Изготавливать из него различные конструкции не труднее, чем из нержавеющей стали. Титан — немагнитный материал с низкой электропроводностью, что особенно ценно, так как благодаря этому можно использовать физиотерапию для лечения больных, в организме которых находятся титановые конструкции. Все это делает титан весьма перспективным для широкого применения в медицине.
Но самым важным результатом многолетних и тщательных исследований оказалось то, что титан является инертным металлом по отношению к биологической среде. Конструкции из титановых сплавов хорошо переносится человеческим организмом, обрастает костной и мышечной тканью. Металл практически не корродирует в агрессивных средах человеческого тела, а структура тканей, окружающих титановые конструкции, не изменяется на протяжении длительного времени. Своей химической индифферентностью титан превосходит не только все нержавеющие стали, но и нашедший в последнее время широкое применение «виталлиум» — сплав на кобальтовой основе. Ценно, что технически чистый титан содержит гораздо меньше примесей, чем другие используемые в медицине сплавы.
Не нашли, что искали? Воспользуйтесь поиском: