
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Физические свойства
КАРБОНОВЫЕ КИСЛОТЫ
Схема лекции.
1. Классификация, номенклатура, изомерия.
2. Способы получения
2.1. Промышленные способы.
2.2. Гидролиз нитрилов.
2.2.1. Гидролиз нитрилов полученных из галогенопроизводных.
2.2.2. Гидролиз нитрилов полученных из карбонильных соединений.
2.3. Гидролиз сложных эфиров.
2.4. Карбоксилирование металлорганических соединений
3. Физические свойства
4. Химические свойства
4.1. Кислотно-основные свойства карбоновых кислот
4.2. Реакции, сопровождающиеся разрывом связи О-Н.
4.3. Реакции, сопровождающиеся разрывом связи С-О.
4.4. Реакции нуклеофильного присоединения по карбонильной группе.
4.5. Реакции замещения атома водорода у α-углродного атома.
4.6. Свойства производных карбоновых кислот.
4.6.3. Реакция переэтерификации
4.7. Особые свойства непредельных одноосновных кислот и их производных.
4.8. Особые свойства двухосновных предельных кислот
4.8. Особые свойства двухосновных предельных кислот
4.9 Особые свойства двухосновных непредельных кислот
4.10. Свойства ароматических карбоновых кислот
Органические соединения, содержащие карбоксильную группу –СООН, называются карбоновыми кислотами.
По числу карбоксильных групп различают одно-, двух-, трех и многоосновные кислоты.
В зависимости от того, с каким радикалом связана карбоксильная группа, различают насыщенные, ненасыщенные и ароматические органические кислоты.
Одноосновные предельные карбоновые кислоты имеют общую формулу СnH2nO2 или СnH2n+1COOH.
1. Классификация, номенклатура, изомерия.
Изомерия карбоновых кислот сводится к изомерии углеродного скелета. Кислоты с числом углеродных атомов меньше четырех изомеров не имеют. Кислота, углеродный скелет которой построен из четырех углеродных атомов, имеет два изомера. Число изомеров растет с ростом углеродного остова.
Действуют три номенклатуры.
По тривиальной номенклатуре карбоновые кислоты имеют собственные, исторически сложившиеся названия. Приставка «изо» используется для обозначения карбоновых кислот с изомерным строением углеродного скелета, которые содержат метильную группу на удаленном от карбоксильной группы конце цепи.
Рациональная номенклатура карбоновых кислот имеет несколько версий. Классический вариант, когда карбоновые кислоты рассматриваются как производные уксусной кислоты, в которой атомы водорода метильного радикала замещены на какие-то другие радикалы. Замещенные ароматические карбоновые кислоты бензольного и нафталинового рядов рассматриваются как производные бензойной и нафтойной кислот.
Для замещенных в углеводородный радикал кислот, положения заместителей, обозначают буквами греческого алфавита α, β, γ, δ и т.д.
Кроме того, названия кислот алициклического и гетероциклического рядов образуют путем прибавления к названию углеводорода или гетероарена суффикса «карбоновая кислота»
По систематической номенклатуре карбоновую кислоту называют по соответствующему предельному углеводороду с добавлением суффикса «- овая кислота». Причем карбоксильная группа всегда имеет первый номер. В дикарбоновых кислотах добавляется суффикс «- диовая кислота».
В иерархии функциональных групп карбоксильную группу обозначается после кетонной. Т.е. после альдегидной-, кетонной-, гидрокси-группы, кратной связи, алкила и галоида. Например:

Примеры насыщенных карбоновых кислот:

Примеры насыщенных дикарбоновых кислот:

Примеры ненасыщенных карбоновых и дикарбоновых кислот:
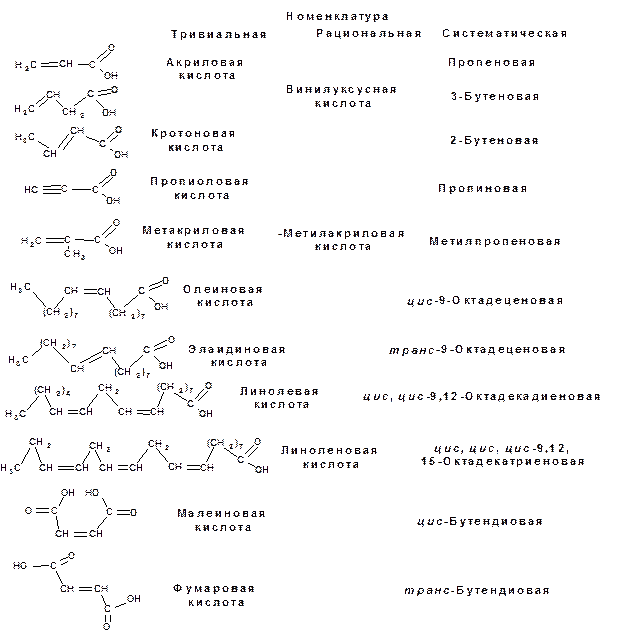
Примеры ароматических карбоновых и дикарбоновых кислот:
 +
+
Для различных фрагментов карбоновых кислот приняты следующие обозначения:

Наиболее распространенные радикалы кислот – ацилы:

В ходе реакций с участием карбоновых кислот наиболее часто образуются соединения общей формулы:
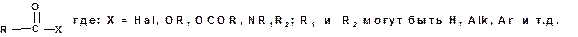
Такие соединения называются функциональными производными карбоновых кислот. Ацильная группа является общим структурным элементом функциональных производных карбоновых кислот.
Функциональные производные карбоновых кислот или просто производные карбоновых кислот, в которых гидроксигруппа у ацильного атома углерода замещена на галоген называются галогенангидридами карбоновых кислот (ацилгалогенидами):

Название галогенангидридов карбоновых кислот образуется от названия карбоновой кислоты путем замены суффикса «- овая кислота» на суффикс «- оилгалогенид». Например, этаноилхлорид (ацетилхлорид), бензоилхлорид, 3-метилпентаноилбромид.
Производные карбоновых кислот, в которых гидроксигруппа у ацильного атома углерода замещена на ацилоксигруппу называются ангидридами карбоновых кислот:

Название ангидридов строится по названию соответствующих кислот. Например, уксусный ангидрид, малеиновый ангидрид, фталевый ангидрид.
Производные карбоновых кислот, в которых гидроксигруппа у ацильного атома углерода замещена на алкоксигруппу называются сложными эфирамикарбоновых кислот:
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты «- овая» на суффикс «- оат». Например:
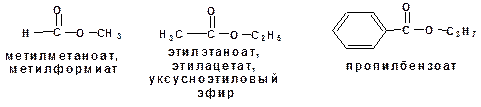
Производные карбоновых кислот, в которых гидроксигруппа у ацильного атома углерода замещена на аминогруппу называются амидамикарбоновых кислот:
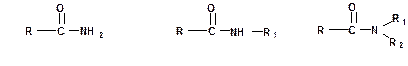
Аминогруппа в амидах может иметь один или два заместителя.
В названиях амидов суффикс названия кислоты «- овая» заменяется на суффикс «- амид». Причем если атом азота имеет заместителей, то указывается положение и количество заместителей. Например:

Соединения, содержащие группу -СºN вместо –С(=О)-Х, также относятся к производным карбоновых кислот и называются нитрилами:
R-CºN
Нитрилы можно рассматривать как ангидриды амидов потому, что образуются при дегидратации амидов и наоборот гидролиз нитрилов приводит к образованию амидов:
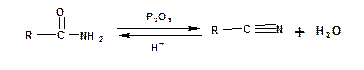
Названия нитрилов строятся добавлением суффикса «-нитрил» к названию углеводорода, причем атом углерода цианогруппы включается в общее количество. Например:

Способы получения
На самостоятельную проработку:
гидролиз геминальных тригалогенопроизводных
озонолиз алкенов;
окисление циклоалканов;
окисление алкенов и алкинов в жестких условиях;
окисление спиртов;
окисление альдегидов и кетонов;
окисление бензола, нафталина, гомологов бензола;
2.1. Промышленные способы
В промышленности насыщенные одноосновные карбоновые кислоты получают прямым окислением углеводородов кислородом воздуха:
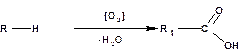
Низшие углеводороды, с числом углеродных атомов меньше 8-ми, окисляются в газовой фазе. Высшие углеводороды с числом атомов от 10 до 30 для получения так называемых СЖК (синтетические жирные кислоты) окисляются в жидкой фазе.
Окислением олефинов получают непредельные карбоновые кислоты. В частности окислением пропилена получают акриловую кислоту:
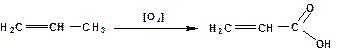
Окислением изобутилена получают метакриловую кислоту:
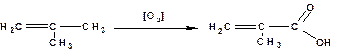
Гидрокарбоксилирование: взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии катализатора (тетракарбонил никеля) получают смесь кислот нормального и изомерного строения:
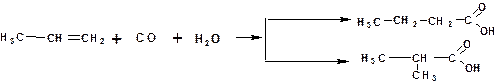
Гидролиз нитрилов
2.1.1. Гидролиз нитрилов полученных из галогенопроизводных
Исходными веществами являются галогеналкилы, из которых получают нитрилы действием цианида калия. В дальнейшем нитрилы подвергаются кислотному или щелочному гидролизу:

Например, винилуксусную кислоту получают по схеме:
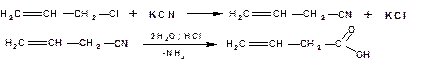
Фенилуксусную кислоту получают по схеме:
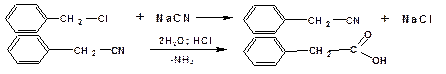
Янтарную кислоту можно получить по схеме:
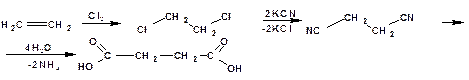
2.1.2. Гидролиз нитрилов полученных из карбонильных соединений
Гидролизом α-гидроксинитрилов получают метакриловую кислоту и ее метиловый эфир:
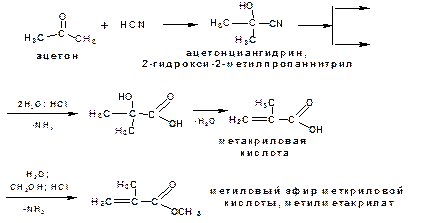
2.3. Гидролиз сложных эфиров.
При нагревании сложного эфира в присутствии разбавленного водного раствора щелочи протекает реакция:

В природе широко распространены сложные эфиры глицерина и высших насыщенных и ненасыщенных карбонов кислот, которые известны как жиры. Эфиры насыщенных кислот при нормальных условиях являются твердыми веществами. Сюда относятся жиры животного происхождения. Эфиры ненасыщенных кислот при нормальных условиях являются жидкостями. Это растительные масла. Из насыщенных кислот основную массу составляют пальмитиновая и стеариновая кислоты:
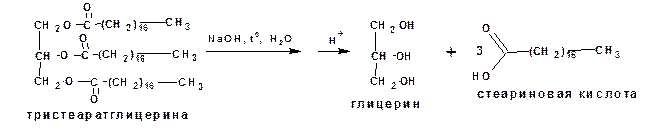
Из высших ненасыщенных кислот основное значение имеет олеиновая кислота:

Процесс гидролиза жиров называется омылением. Непосредственно после гидролиза образуются соли карбоновых кислот, которые называются мылами. Получаемая при омылении животных жиров смесь твердых жирных кислот называется стеарином. Из стеарина с добавкой парафина изготавливают свечи.
2.4. Карбоксилирование металлорганических соединений
Карбоксилирование металлоорганических реагентов является универсальным способом получения карбоновых кислот:
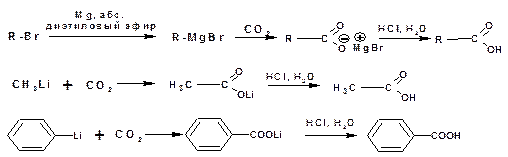
Получение щавелевой кислоты при нагревании формиата натрия.
Физические свойства
Муравьиная и уксусные кислоты обладают раздражающим запахом. Масляная, валериановая, и капроновая кислоты маслянистые малоподвижные жидкости с неприятным запахом. Высшие жирные и ароматические кислоты не имеют запаха, поскольку обладают малой летучестью. Температуры кипения кислот выше, чем у соответствующих спиртов. Данное различие обусловлено большей полярностью молекул карбоновых кислот и более прочными водородными связями, которые они образуют в соответствующих димерах. Димеры карбоновых кислот устойчивы даже в газообразном состоянии. Молекулы каробоновых кислот образуют с молекулами воды прочные водородные связи. Однако лишь первые четыре члена гомологического ряда алифатических карбоновых кислот смешиваются с водой в любых соотношениях.
Группы С=О и О-Н, образующие карбоксильную систему, влияют друг на друга. Соответственно их свойства отличаются от гидроксильной группы спиртов и карбонильной группы альдегидов и кетонов. Для карбоксильной группы можно привести резонансные структуры:

НЭП атома кислорода гидроксильной группы способна участвовать в р-π-сопряжении с π-электронной системой двойной связи карбоксильной группы. Делокализация делает атом углерода карбонильной группы менее электрофильнфым, чем атом углерода в карбонильной группе альдегидов или кетонов. Карбоновая кислота имеет три реакционных центра:
реакции, сопровождающиеся разрывом связи О-Н
реакции, сопровождающиеся разрывом связи С-О
реакции нуклеофильного присоединения по связи С=О карбонильной группы
реакции замещения атома водорода у α-углродного атома.
Не нашли, что искали? Воспользуйтесь поиском: