
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Распространенные элементы. строение атомов. Электронные оболочки. Орбитали
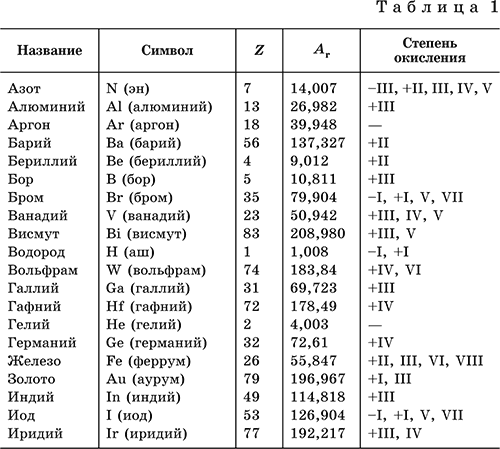
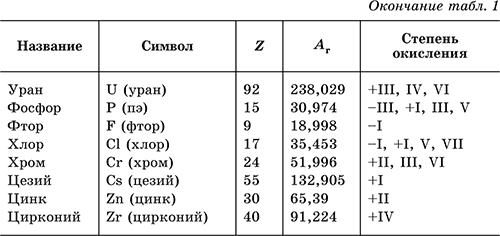
Химический элемент – определенный вид атомов, обозначаемый названием и символом и характеризуемый порядковым номером и относительной атомной массой.
В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления.
Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.

Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1 р+ в ядре и на периферии 1 е ‑; в атоме элемента кислород О находится 8 р+ в ядре и 8 е ‑ в оболочке; атом элемента алюминий Аl содержит 13 р + в ядре и 13 е ‑ в оболочке.
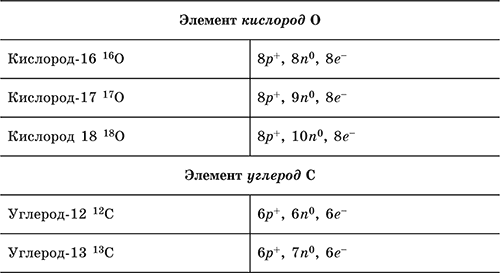
Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород‑1 (специальное название и символ протий 1H) с 1 р+ в ядре и 1 е ‑ в оболочке; водород‑2 (дейтерий 2Н, или D) с 1 р+ и 1 п 0 в ядре и 1 е ‑ в оболочке; водород‑3 (тритий 3Н, или Т) с 1 р+ и 2 п 0 в ядре и 1 е ‑ в оболочке. В символах 1Н, 2Н и 3Н верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре. Другие примеры:
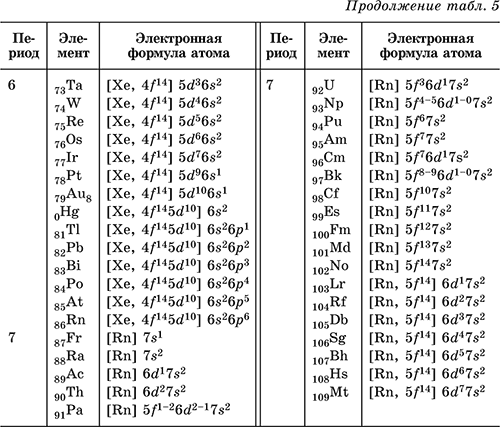
Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.

Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3‑й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1‑го уровня s‑подуровня), 2 s, 2 р, 3 s, 3 р, 3d, 4 s … Число орбиталей в подуровнях:

Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
1) принцип минимума энергии
Не нашли, что искали? Воспользуйтесь поиском: