
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
По завершенню вивчення курсу проводиться екзамен.
РОБОЧИЙ ЗОШИТ
З АНАЛІТИЧНОЇ ХІМІЇ (ЧАСТИНА ДРУГА)
Галузь знань: 0517 ”Харчова промисловість та переробка сільськогосподарської продукції”
Напрям підготовки: 5.051701 «Харчові технології та інженерія»
Спеціальність: 5.05170101 ”Виробництво харчової продукції”
Кваліфікація: Молодший спеціаліст
Відділення: Харчових технологій
Студента групи № _________________
(Прізвище, ім’я, по батькові.)
Викладач: Тарасенко Володимир Миколайович
Луцьк 2017
Тарасенко В.М. Робочий зошит з аналітичної хімії (частина друга) для студентів спеціальності 5.05170101 «Виробництво харчової продукції», напрям підготовки 6.051701 «Харчова технологія та інженерія», галузь знань 0517 «Харчова промисловість та переробка сільськогосподарської продукції». Методичний збірник. Луцьк ВоК НУХТ, 2017, 56с.
В робочому зошиті викладені всі теми для проведення аудиторних лабораторних та практичних занять з аналітичної хімії протягом шостого семестру (14 годин лабораторних робіт та 22 години практичних робіт), а також передбачене місце для самостійної роботи, яка також включає написання реферату по темі, що попередньо індивідуально погоджується з викладачем.
Укладач вдячний Всім, хто свідомо чи підсвідомо допоміг і допомагає у створенні цього зошиту.
Укладач: Тарасенко В.М., викладач вищої категорії, старший викладач.
Рецензент: Богдан Г.І., голова циклової комісії природничо-математичної підготовки ВоК НУХТ, викладач вищої категорії, викладач методист.
Розглянуто на засіданні циклової комісії природничо-математичної підготовки ВоК НУХТ, протокол № 6 від 25 січня 2017р.
Зміст
| Тема | Сторінка |
| Загальні вказівки. | |
| Заняття №1. Практична робота. Інструментальні методи аналізу. | |
| Заняття №2. Лабораторна робота. Визначення густини розчину ацетатної кислоти за допомогою ареометру. | |
| Заняття №3. Практична робота. Рефрактометрія. | |
| Заняття №4.Практична робота. Поляриметрія. | |
| Заняття №5.Практична робота. Атомно-емісійний спектральний аналіз. | |
| Заняття № 6.Практична робота. Атомно-абсорбційний спектральний аналіз. | |
| Заняття № 7. Практична робота. Метод молекулярної абсорбції. | |
| Заняття № 8.Лабораторна робота. Метод молекулярної абсорбції. | |
| Заняття № 9. Практична робота. Турбідиметрія, нефелометрія. | |
| Заняття № 10. Практична робота. Люмінісцентний аналіз. | |
| Заняття № 11.Практична робота.Потенціометрія. Потенціометричне титрування. | |
| Заняття № 12. Лабораторна робота. Потенціометричне визначення рН розчинів та концентрації нітрат іонів за допомогою іонселективного електроду. | |
| Заняття № 13. Лабораторна робота. Потенціометричне титрування. Визначення вмісту кислот в напоях. | |
| Заняття № 14.Практична робота. Кондуктометрія, кондуктометричне титрування, вольтамперометрія та полярографія. | |
| Заняття № 15. Лабораторна робота. Кондуктометричне титрування. Визначення вмісту хлоридної та ацетатної кислот при кондуктометричному титруванні їх суміші. | |
| Заняття № 16.Практична робота. Хроматографія. | |
| Заняття № 17.Лабораторна робота. Визначення вмісту органічних розчинників хроматографічним способом. | |
| Самостійна робота(реферат). | |
| Для самостійної роботи. | |
| Заняття № 18.Підсумкова практична робота. | |
| Література. | |
Загальні вказівки
П редмет «Аналітична хімія» вивчається студентами Волинського коледжу НУХТ спеціальності 5.05170101 «Виробництво харчової продукції» протягом п’ятого та шостого семестрів третього курсу (перша та друга частини).
Протягом п’ятого семестру передбачено:
22 академічні аудиторні години лекційних занять,
10 академічних аудиторних годин практичних занять,
22 академічні години самостійної роботи.
Після успішного опрацювання першої частини виставляється диференційований залік.
Протягом шостого семестру передбачено:
8 академічних аудиторних години лекційних занять,
14 академічних аудиторних годин лабораторних занять,
22 академічні аудиторні години практичних занять,
37 академічних годин самостійної роботи, яка є важливою складовою як учбового процесу студентів, так і взагалі успішної життєдіяльності всіх людей. Саме самостійна робота дозволяє реалізувати всі внутрішні потреби особистості, що фактично є запорукою щасливого життя.
По завершенню вивчення курсу проводиться екзамен.
Заняття №1. Практична робота.
Тема: Інструментальні методи аналізу.
Мета: Засвоїти основні методи обробки аналітичних сигналів.
Що може слугувати в якості аналітичних сигналів в інструментальних методах аналізу?
Навести приклади прямих та непрямих способів визначення концентрації за аналітичним сигналом.
Описати наступні методи обробки аналітичних сигналів:
1. Метод градуювального графіку:
2. Метод порівняння зі стандартним розчином.
3. Метод добавок.
4. Метод розрахунку за формулою.
Основні переваги та недоліки інструментальних методів аналізу.
Заняття №2. Лабораторна робота.
Тема: Денситометрія. Визначення густини розчину ацетатної кислоти за допомогою ареометру.
Мета: Засвоїти основни денситометрії.
Теоретичні основи.
На чому базується денситометричний метод аналізу? __________________
________________________________________________________________
Що показує густина розчинів? _____________________________________
________________________________________________________________
Одиниці вимірювання густини розчинів ______________________________
Фактори від яких залежить густина розчинів __________________________
________________________________________________________________
_______________________________________________________________
Методи вимірювання густини розчинів ______________________________
________________________________________________________________
Замалюйте вимірювання густини розчинів за допомогою ареометра.
Як перевірити чи вірно підібраний ареометр для вимірювання густини?
________________________________________________________________
________________________________________________________________
Які ареометри мають шкалу в одиницях концентрації речовини?
________________________________________________________________
В яких координатах будують градуювальний графік в денситометрії?
________________________________________________________________
________________________________________________________________
Хід роботи.
1. Побудувати градуювальний графік для визначення концентрації ацетатної кислоти користуючись наступними даними з довідника
2. Визначити густину розчину ацетатної кислоти невідомої концентрації за допомогою ареометру при 20°С
3. По градуювальному графіку встановити концентрацію ацетатної кислоти в розчині.
| Концентрація розчину к-ти (%) | Густина розчину г/см3 (при 20°С) | Концентрація розчину к-ти (%) | Густина розчину г/см3 (при 20°С) |
| 4,64 8,14 11,7 | 1,000 1,005 1,010 1,015 | 15,4 19,2 23,1 27,2 | 1,020 1,025 1,030 1,035 |
При вимірюванні густини отримали наступний результат _______________
- По градуювальному графіку встановили, що концентрація ацетатної кислоти в розчині становить____________________________________
Висновок: _______________________________________________________
________________________________________________________________
Заняття №3. Практична робота.
Тема: Практична робота. Рефрактометрія. Визначення вмісту жиру у вершковому маслі.
Мета: Засвоїти основи рефрактометрії.
Теоретичні основи:
На чому ґрунтується рефрактометричний метод аналізу? _______________
________________________________________________________________
________________________________________________________________
Які прилади використовують для рефрактометричного методу аналізу?
_______________________________________________________________
Замалюйте хід променю світла при переході з одного середовища в інше. Що таке показник заломлення? Як він позначається?
Фактори, від яких залежить показник заломлення:
________________________________________________________________
________________________________________________________________
Яку довжину хвилі, як правило, використовують в рефрактометрах, як це позначають?
________________________________________________________________
Як можна перевірити рефрактометр перед початком вимірювань?
________________________________________________________________
________________________________________________________________
Що таке рефрактометричний фактор? _______________________________
________________________________________________________________
Хід роботи.
Метод ґрунтується на вимірюванні показника заломлення розчину жиру в органічному розчиннику з відомим і більш високим, ніж для жиру, показником заломлення. Наприклад в α-монобромнафталіні. Вершкове масло в середньому містить 83% жиру.
1. В хімічній склянці зважують 10 г вершкового масла. Піпеткою приливають 5,00 мл α-монобромнафталіна (користуючись гумовою грушею), склянку нагрівають у водяній бані до 40°С, щоб розтопити масло. Для зневоднення масла та видалення білків до взятої проби додають 2-3 г сульфату натрію, суміш ретельно розтирають скляною паличкою протягом 2-3 хв. Після того, як білки осядуть на дно склянки, 2-3 краплі прозорої рідини наносять капіляром на нижню призму рефрактометра, потім опускають верхню призму та вимірюють показник заломлення при 20°С з точністю 0,0001.
2. Вимірювання повторюють декілька раз та обчислюють середнє арифметичне значення показника заломлення.
3. Вміст жиру в аналізованому маслі обчислюють за формулою:

де v – об’єм розчинника, мл,
d – густина жиру при 20°С (0,920 г/см3),
m – маса проби вершкового масла,
n1 – показник заломлення α-монобромнафталіна 1,6580 при 20°С,
n2 – показник заломлення розчину жиру в α-монобромнафталіні,
n3 – показник заломлення жиру (1,4606 – 1,4640 при 20°С). За вищенаведеним рівнянням можна спочатку обчислити показники заломлення розчинів жиру в залежності від вмісту жиру і потім їх використовувати.
Отримані результати та обчислення.
Висновок: _______________________________________________________
________________________________________________________________
Заняття №4. Практична робота.
Тема: Практична робота. Поляриметрія. Визначення концентрації цукрози в сиропах.
Мета: Засвоїти основи поляриметрії.
Теоретичні основи:
На чому ґрунтується поляриметричний метод аналізу? _________________
________________________________________________________________
Які речовини називають оптично активними?_________________________
________________________________________________________________
Як пов’язана оптична активність розчинів речовин з їх хімічною будовою?
________________________________________________________________
________________________________________________________________
Принцип роботи поляриметра та принципова схема поляриметра
________________________________________________________________
________________________________________________________________
Яке світло називають плоскополяризованим? _________________________
________________________________________________________________
Замалювати вектор променю неполяризованого та плоскополяризованого світла
Що таке питоме обертання площини поляризації, та як його позначають?
________________________________________________________________
________________________________________________________________
Фактори, від яких залежить питоме обертання ________________________
________________________________________________________________
За якою формулою можна обчислити концентрацію розчину знаючи
питоме обертання ________________________________________________
Хід роботи.
Метод ґрунтується на вимірюванні кута обертання площини поляризації розчинами цукрози у воді та визначенні концентрації цукрози за градуювальник графіком.
1. Для побудови градуювального графіка зважують 10, 20, 30 та 40 г цукрози, проби поміщають у мірні колби на 100 мл, розчиняють у дистильованій воді і при перемішуванні доводять об’єми стандартних розчинів водою до мітки.
2. Піпетку та поляриметричну трубку ополіскують стандартним розчином цукрози з найменшою концентрацією, за допомогою піпетки заповнюють поляриметричну трубку розчином. Вмикають освітлювач, встановлюють максимум інтенсивності освітлення та нульову точку. Трубку поміщають у прилад і, стежачи в окуляр, обертанням аналізатора досягають рівної освітленості оптичних полів.
3. Проводять 4-5 повторних вимірювань. Трубку повертають на 180°, роблять 4-5 відліків та вираховують середнє арифметичне усіх вимірювань. Такі самі операції виконують зі стандартними розчинами інших концентрацій.
4. За отриманими даними будують градуювальник графік у координатах: концентрація цукрози – кут обертання площини поляризації.
5. Прозорий сироп з невідомим вмістом цукрози поміщають у попередньо промиту аналізованим сиропом поляриметричну трубку і вимірюють кут обертання площини поляризації. Вимірювання повторюють 4-5 разів, обчислюють середнє арифметичне значення і за калібрувальним графіком знаходять невідому концентрацію цукрози.
Результати вимірювань:
| Маса цукрози (г) | Концентрація цукрози (%) | α° | α° | α° | α° | α° | α° | α° | α° | α° сер |
Отримані результати та обчислення.
Висновок: _______________________________________________________
________________________________________________________________
Заняття №5. Практична робота.
Тема: Атомно-емісійний спектральний аналіз. Полуменево-фотометричне визначення лужних та лужноземельних металів.
Мета: Засвоїти основи атомно-емісійного спектрального аналізу.
Теоретичні основи:
На чому базується атомно-емісійний спектральний аналіз? _____________
________________________________________________________________
________________________________________________________________
Що можна визначати за допомогою цього методу?_____________________
________________________________________________________________
Що таке спектр випромінювання певного хімічного елементу та як його
отримують? _____________________________________________________
________________________________________________________________
Чи всі спектральні лінії використовують для аналізу?___________________
________________________________________________________________
________________________________________________________________
Яким рівнянням виражається залежність між інтенсивністю спектральної
лінії та концентрацією хімічного елемента в пробі? ____________________
________________________________________________________________
Як відокремлюють з спектру необхідну для аналізу довжину хвилі?
________________________________________________________________
Що таке метод добавок? ___________________________________________
________________________________________________________________
Формула для розрахунку концентрацій хімічних елементів методом добавок
________________________________________________________________
Практичне застосування методу в харчовій промисловості ______________
________________________________________________________________
Замалюйте принципову схему роботи полуменевого фотометра.
Хід роботи.
1. У три мірні колби поміщають по 5,00 мл аналізованого соку. В другу колбу додають 10,00 мл, а в третю 20,00 мл стандартного розчину хлориду натрію. В усіх колбах додають до мітки дистильовану воду та вміст колб перемішують.
2. Розчини по черзі наливають у хімічну склянку та розпилюють у полум’ї полуменевого фотометра. Для визначення іонів натрію застосовують довжину хвилі 589 нм.
3. Вміст іонів натрію обчислюють за формулою:

Де W – вміст іонів натрію мг/л,
20 – кратність розбавлення соку,
C – концентрація іонів натрію за рахунок добавки,
A – показники мікроамперметра без добавки,
B – показники мікроамперметра з добавкою
4. Вміст іонів калію та кальцію визначають аналогічно, але замість стандартного розчину хлориду натрію застосовують стандартні розчини хлориду калію та хлориду кальцію, а також вимірювання проводять на довжинах хвилі 768 нм для калію та 622 нм для кальцію.
Вихідні дані та розрахунки концентрацій іонів натрію в сокові.
Вихідні дані та розрахунки концентрацій іонів калію в сокові.
Вихідні дані та розрахунки концентрацій іонів кальцію в сокові.
Висновки:
Заняття №6. Практична робота.
Тема: Атомно-абсорбційний спектральний аналіз. Визначення концентрацій мікро домішок іонів важких та токсичних металів у м’ясі, рибі та консервах атомно-абсорбційним методом аналізу
Мета: Засвоїти основи атомно-абсорбційного спектрального аналізу.
Теоретичні основи:
На чому базується атомно-абсорбційний спектральний аналіз? __________
________________________________________________________________
________________________________________________________________
Що можна визначати за допомогою цього методу?_____________________
________________________________________________________________
Практичне застосування методу в харчовій промисловості ______________
________________________________________________________________
_______________________________________________________________
Замалюйте принципову схему роботи атомно-абсорбційного спектрофотометра
Які джерела світла використовуються в цьому способі? ________________
________________________________________________________________
________________________________________________________________
Яка чутливість цього методу аналізу? _______________________________
________________________________________________________________
Що таке фон або випромінювання атомізатора та як нейтралізують його вплив?__________________________________________________________
________________________________________________________________
Які переваги та недоліки цього методу аналізу? ______________________
________________________________________________________________
Хід роботи.
1. Визначення базується на поглинанні атомами купруму у полум’ї суміші пропан-бутанову та повітря резонансного випромінювання спектральної лінії 324,7 нм, що одержується від лампи з катодом що містить купрум.
2. Для переведення іонів купруму в розчинний стан проводять попередню підготовку проб. Для цього 1 г проби в склянці, накритій годинниковим склом, кип’ятять з 10 мл розчину хлоридної кислоти розбавленої у співвідношенні 1:1 і випаровують до 3 мл. Відфільтровують для відокремлення нерозкладених жиріву у мірну колбу на 25 мл.
3. Так готують три колби. У другу та в третю додають відповідно 5 та 10 мл стандартного розчину солі що містить іони купруму.
4. По черзі розпилюють розчини у полум’ї атомно-абсорбційного спектрофотометра використовуючи довжиу хвилі 324,7 нм.
5. Вміст іонів купруму обчислюють за формулою:

Де W – вміст іонів купруму мг/л,
25 – кратність розбавлення проби,
C – концентрація іонів купруму за рахунок добавки,
A – показники мікроамперметра без добавки,
B – показники мікроамперметра з добавкою
6. Вміст іонів цинку та кадмію визначають аналогічно, але замість стандартного розчину іонів купруму застосовують стандартні розчини іонів цинку та кадмію, а також використовують лампи з катодами що містять цинк та кадмій і використовуючи довжини хвиль резонансного поглинання цинку та кадмію.
Вихідні дані та розрахунки концентрацій іону купруму в сокові.
Вихідні дані та розрахунки концентрацій іонів цинку в сокові.
Вихідні дані та розрахунки концентрацій іонів кадмію в сокові.
Висновки:
Заняття №7. Практична робота.
Тема: Метод молекулярної абсорбції.
Мета: Засвоїти основи методу молекулярної абсорбції.
Теоретичні основи:
На чому базується молекулярно-абсорбційний (фотометричний) аналіз?
________________________________________________________________
________________________________________________________________
Закон Бугера-Ламберта-Бера _______________________________________
Що таке оптична густина розчину? __________________________________
________________________________________________________________
Що таке молярний коефіцієнт поглинання? ___________________________
________________________________________________________________
________________________________________________________________
Від яких факторів залежить молярний коефіцієнт поглинання?
________________________________________________________________
Що таке розчин порівняння?________________________________________
________________________________________________________________
Замалюйте залежність інтенсивності променю, що вийшов, від товщини кювети та оптичної густини розчину від товщини кювети.
Яку довжину хвилі використовують в методі молекулярної абсорбції?
Які прилади використовують в методі молекулярної абсорбції, замалюйте їх принципову схему.
1. Для визначення вмісту Феруму в томатному сокові методом молекулярної абсорбції 5,00 мл соку піддали мокрому озоленню в тиглі, кількісно перенесли в мірну колбу місткістю 50,00 мл, додали фенантролін і довели водою до мітки. При цьому утворився оранжево-червоний комплекс з оптичною густиною 0,23. Для побудови калібрувального графіку приготували з використанням фенатроліну серію стандартних розчинів з такими концентраціями Феруму в мкг/л: 10,0; 20,0; 30,0; 50,0; 80,0; 100,0. Оптична густина цих розчинів становила: 0,05; 0,11; 0,15; 0,26; 0,42; 051. Визначити концентрацію Феруму в мкг/л в томатному сокові.
2. Оптична густина розчину Ферум трисульфосалицилату виміряна при 433 нм у кюветі з товщиною шару розчину 2 см, дорівнює 0,15. Для реакції брали 4 мл розчину іонів Феруму концентрацією 0,000582 моль/л які переносили у мірну колбу на 50,00 мл і після додавання сульфосаліцилат іону доводили до мітки дистильованою водою. Обчислити значення молярного коефіцієнту світло поглинання утвореної сполуки.
Заняття №8. Лабораторна робота.
Тема: Метод молекулярної абсорбції. Визначення вмісту іонів Cu2+ у воді фотометричним методом.
Мета: опанувати основи фометричного аналізу на прикладі визначення вмісту іонів Cu2+ у воді способом молекулярної абсорбції.
Прилади та реактиви: робочі халати, спектрофотометр ULAB 102, аналітична вага, сіль купрум сульфат кристалогідрат (мідний купорос), 0,5% розчин амоній гідроксиду, 6 мірних колб на 100,0 мл, лійка, мірна піпетка з поділками на 5,00 мл, дистильована вода.
Теоретичні відомості.
Фотометричний аналіз (спосіб молекулярної абсорбції) базується на вимірюванні світлопоглинання розчинами інтенсивнозабарвлених речовин, яке пропорційне концентрації визначуваної речовини. Кількісно світлопоглинання характеризується оптичною густиною (D) розчину: 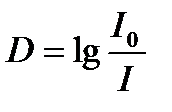 .
.
I0 та I – інтенсивність світла до і після його поглинання розчином забарвленої сполуки. При цьому оптична густина прямо пропорційна концентрації визначуваної речовини. Для вимірювання світлового потоку використовують прилади спектрофотометри або фотоколориметри.
Хід роботи
Побудова калібрувального графіка.
1. Взяти наважку CuSO4*5H2O з точністю до третього знаку після коми. Маса наважки повинна знаходитись в межах 0,400 – 0,600 г.
Маса наважки CuSO4*5H2O становить г.
2. Наважку кількісно перенести в мірну колбу на 100,00 мл і розчинити в дистильованій воді.
3. В п’ять мірних колб додати: 0,50; 1,00; 2,00; 3,00, 5,00 мл, розчину CuSO4 і довести до мітки 0,5% розчином амоній гідроксиду. Вміст колб перемішати. При додаванні розчину амоній гідроксиду іони Cu2+ утворюють інтенсивно забарвлену комплексну сполуку.
CuSO4 + 4 NH4OH = [Cu(NH3)4]SO4 + 4 H2O
4. Спочатку, для визначення довжині хвилі, на якій світлопоглинання сполуки максимальне, будуємо спектр світлопоглинання розчину [Cu(NH3)4]SO4. Для цього визначаємо оптичну густину одного з розчинів на різних довжинах хвиль. Отримані дані заносимо в таблицю. Використовуємо кювету з товщиною шару розчину 1,00 см. В якості розчину порівняння використовуємо 0,5% розчин амоній гідроксиду.
Таблиця 1. Залежність оптичної густини розчину [Cu(NH3)4]SO4 від довжини хвилі. Товщина кювети 1 см.
| Довжина хвилі, нм. | Оптична густина розчину. |
5. Побудувати спектр світлопоглинання розчину [Cu(NH3)4]SO4 в координатах: залежність оптичної густини розчину від довжини хвилі.
Рис 1. Графік залежності оптичної густини розчину [Cu(NH3)4]SO4 від довжини хвилі.
6. Знайти довжину хвилі, на якій оптична густина розчину максимальна. λ = нм.
В подальшому завжди використовуємо саме цю довжину хвилі.
7. Для побудови калібрувального графіка виміряти оптичну густину розчинів [Cu(NH3)4]SO4 різної концентрації. Отримані дані занести в таблицю. Концентрації іонів Cu2+ розрахувати за формулою:
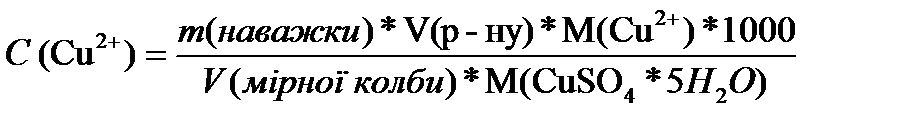
С(Cu2+) в першій колбі =
С(Cu2+) в другій колбі =
С(Cu2+) в третій колбі =
С(Cu2+) в четвертій колбі =
С(Cu2+) в п’ятій колбі =
Таблиця 2. Дані для побудови калібрувального графіка.
| Номер колби. | Об’єм розчину CuSO4, що був доданий у мірну колбу, мл. | Концентрація іонів Cu2+, мг/л. | Оптична густина розчину. |
| 0,50 | |||
| 1,00 | |||
| 2,00 | |||
| 3,00 | |||
| 5,00 |
8. Будуємо калібрувальний графік в координатах: залежність оптичної густини розчину від концентрації іонів Cu2+.
Рис 2. Калібрувальний графік для визначення концентрації іонів Cu2+.
Визначення маси іонів Cu2+ у пробі води.
9. Отримати в учбового майстра в мірній колбі на 100,0 мл задачу на визначення маси іонів Cu2+ у пробі води.
10. Отриману пробу довести до мітки 0,5% розчином амоній гідроксиду. Вміст колби перемішати, заповнити розчином кювету та визначити оптичну густину отриманого розчину. D=
11. По калібрувальному графіку визначити концентрацію іонів Cu 2+ (в мг/л) у мірній колбі.
12. Розрахувати масу іонів Cu 2+ в отриманому зразку води (в міліграмах) перемноживши концентрацію іонів Cu 2+ (в мг/л) у мірній колбі на об’єм мірної колби (у літрах).
13. Зробити висновок і захистити роботу у викладача.
Оцінка роботи студента викладачем:
Заняття № 9. Практична робота.
Тема: Турбідиметрія, нефелометрія.
Мета: Засвоїти основи турбідиметрії та нефелометрії.
Теоретичні основи:
На чому базується нефелометричний метод аналізу? ________________________________________________________________
________________________________________________________________
На чому базується турбідиметричний метод аналізу? __________________
________________________________________________________________
________________________________________________________________
Які прилади застосовуються для нефелометричного методу аналізу?
________________________________________________________________
Замалюйте їх принципову схему
Які прилади застосовуються для турбідиметричного методу аналізу?
________________________________________________________________
Замалюйте їх принципову схему
Для визначення концентрації хлорид іонів у воді нефелометричним методом спочатку побудували калібрувальний графік. Для цього у 5 мірних колб місткістю 50,00 мл ввели з бюретки 1,0; 2,5; 5,0; 7,5; 10,0 мл стандартного розчину хлориду калію. У кожну колбу додали по 20,0 мл етанолу, 10,0 мл нітратної кислоти, 10,0 мл розчину Аргентум нітрату, додали дистильованої води до мітки, перемішали та помістили на 30 хвилин у водяну баню, нагріту до 40°С. Потім колби охолодили струменем водопровідної води до 20°С. При цьому отримали серію суспензій, що містять відповідно 0,1; 0,25; 0,5; 0,75; 1,0 мг/л хлорид іонів. Інтенсивність розсіювання світла цими суспензіями становила 0,12; 0,32; 0,61; 0,94; 1,19. За отриманими даними побудували калібрувальний графік залежності інтенсивності розсіювання світла від концентрації хлорид іонів. Потім у мірну колбу на 50,00 мл ввели 10,00 мл аналізованої води і обробили аналогічно. Інтенсивність розсіювання світла в цьому випадку становила 0,46. Побудуйте калібрувальний графік та визначте концентрацію хлорид іонів у досліджуваній воді.
Висновки:
Заняття № 10. Практична робота.
Тема: Люмінісцентний аналіз.
Мета: Засвоїти основи люмінесцентного аналізу.
Теоретичні основи:
Що таке люмінесценція? __________________________________________
_______________________________________________________________
_______________________________________________________________
Правило Стокса __________________________________________________
_______________________________________________________________
Закон С.І.Вавілова ________________________________________________
_______________________________________________________________
_______________________________________________________________
Замалюйте інтенсивність люмінесценції від концентрації розчинів.
Як впливає на інтенсивність люмінесценції температура?
________________________________________________________________
________________________________________________________________
Застосування люміноскопів в аналітичній хімії.
На чому базується флуориметричний метод аналізу? ________________________________________________________________
________________________________________________________________
Переваги флуориметрії
Замалюйте принципову схему флуориметра.
Для визначення вмісту вітаміну С у виноградному сокові флуориметричним методом відібрали 20 мл соку. Провели відповідну обробку. Отримали 100 мл розчину інтенсивність флуоресценції якого становила 62 одиниці. Інтенсивність флуоресценції стандартного зразка з вмістом вітаміну С 5 мг/л становила 48 одиниць. Розрахуйте способом порівняння зі стандартним розчином скільки міліграмів вітаміну С міститься в 1 літрі соку?
Висновки:
Заняття № 11. Практична робота.
Тема: Потенціометрія, потенціометричне титрування.
Мета: Засвоїти основи потенціометричного методу аналізу.
Теоретичні основи:
На чому базується метод потенціометрії? ____________________________
________________________________________________________________
________________________________________________________________
Рівняння Нернста
Які електроди називають індикаторними?____________________________
________________________________________________________________
Які електроди називають електродами порівняння?____________________
________________________________________________________________
Потенціал якого електрода приймають за нуль? Замалюйте схему цього електрода.
Замалюйте схему скляного електрода. Де його застосовують?
Замалюйте схему хлор-срібного електрода. Де його застосовують?
Які електроди називають іон селективними? Приведіть приклади. Де їх застосовують?
На чому базується метод потенціометричного титрування? _____________
________________________________________________________________
________________________________________________________________
________________________________________________________________
В яких координатах будують графік кривої потенціометричного титрування (інтегральна та диференціальна форми) при кислотно-основному та окисно-відновному потенціометричному титруванні? Зарисуйте криві (інтегральна та диференціальна форми) потенціометричного кислотно-основного та окисно-відновного титрування.
З якою метою будують ці графіки? __________________________________
_______________________________________________________________
Основні переваги та недоліки потенціометричного титрування в порівнянні з звичайним титруванням. _______________________________
________________________________________________________________
________________________________________________________________
Згідно якого закону проводять розрахунки при потенціометричному титруванні?
Висновки:
Заняття № 12. Лабораторна робота.
Тема: Потенціометричне визначення рН розчинів та концентрації нітрат іонів за допомогою іонселективного електроду.
Мета: Засвоїти основи потенціометричного методу аналізу.
рН води та водних розчинів визначають потенціометричним способом за допомогою приладів рН метрів. Спочатку проводять перевірку приладу за допомогою декількох буферних розчинів. Після цього переходять до вимірювання рН розчинів. Необхідно також щоб електроди завжди знаходились у воді, а також слідкувати за рівнем розчину хлориду калію у електроді порівняння.
Результати вимірювання рН різних розчинів заносять у таблицю:
| Розчин | рН | Висновок про середовище розчину |
Для вимірювання концентрації нітрат іонів у водних середовищах використовують іон селективний нітратний електрод ІСЕ (ЕМ-NO3-01).
1. Для побудови градуювального графіка готують серію стандартних розчинів калію нітрату у мірних колбах на 100 мл з такими концентраціями нітат іонів: 0,0001; 0,001; 0,01; 0,1 моль/л. Розчини готують на 1% розчині алюмокалієвих галунів.
2. Вимірюють значення електрорушійної сили та за отриманими результатами будують градуювальник графік у координатах Е= f(-lg C КNO3).
| № колби | Концентрація (С) нітрат іонів (моль/л) | - lg С (NO3-) | Електрорушійна сила (В) |
| 0,0001 | |||
| 0,001 | |||
| 0,01 | |||
| 0,1 |
3. Зразок овочевої продукції очищають, подрібнюють на тертушкі і відважують 20 грам. Потім переносять у мірну колбу на 100 мл і заливають 1% розчином алюмокалієвого галуну. Потім переносять у склянку, 5 хвилин перемішують. Занурюють у суміш електроди і вимірюють електрорушійну силу.
4. За градуювальник графіком знаходять концентрацію нітрат іонів у моль/л. При необхідності роблять перерахунки у г/л.
Результати отримані при аналізі овочевої продукції:
| Назва овочевої продукції | Е.Р.С. отримана при вимірюванні | Концентрація нітрат іонів в овочах |
Висновки:
Заняття № 13. Лабораторна робота.
Тема: Потенціометричне титрування. Визначення вмісту кислот в напоях.
Мета: Засвоїти основи потенціометричного титрування.
1. В хімічний стакан на 100 мл мірною піпеткою відібрати 5,00 мл розчину харчового напою, додати 15-20 мл дистильованої води та для визначення рН розчину занурити в розчин електроди, що підключені до рН метра.
2. Виміряти рН розчину. Потім додати з бюретки 0,5 мл титранту, розчин перемішати та знову виміряти рН розчину. Титрант додавати порціями по 0,5 мл кожного разу перемішуючи розчин та вимірюючи його рН.
3. Отримані в ході титрування дані фіксуємо в таблиці, яку використовуємо для побудови графіків потенціометричного титрування (в інтегральній та диференціальній формах).
Таблиця1. Дані для побудови кривих титрування.
| Загальний об’єм титранту, V мл. | Додано титранту, ΔV мл. | рН розчину | ΔpH розчину | ΔpH ΔV |
| 0,5 | 0,5 | |||
| 1,0 | 0,5 | |||
| 1,5 | 0,5 | |||
| 2,0 | 0,5 | |||
| 2,5 | 0,5 | |||
| 3,0 | 0,5 | |||
| 3,5 | 0,5 | |||
| 4,0 | 0,5 | |||
| 4,5 | 0,5 | |||
| 5,0 | 0,5 | |||
| 5,5 | 0,5 | |||
| 6,0 | 0,5 | |||
| 6,5 | 0,5 | |||
| 7,0 | 0,5 | |||
| 7,5 | 0,5 | |||
| 8,0 | 0,5 | |||
| 8,5 | 0,5 | |||
| 9,0 | 0,5 | |||
| 9,5 | 0,5 | |||
| 10,0 | 0,5 |
4. В ході процесу потенціометричного титрування для визначення точки еквівалентності будуємо криві титрування в інтегральній та диференціальній формах.
5. Титрування завершити, коли розчин набуде лужного середовища та закінчення стрибка титрування (область різкої зміни рН розчину поблизу точки еквівалентності).
6. Встановити об’єм титранту в точці еквівалентності.
V(титранту)=
7. Записати рівняння реакції, що відбувається при титруванні.
8. Розрахувати згідно формул: вміст кислоти (в грамах) у пробі харчового напою взятого для аналізу та (в грамах на літр) у харчовому напої.
Вміст кислоти (в грамах) у пробі розраховуємо згідно формули:
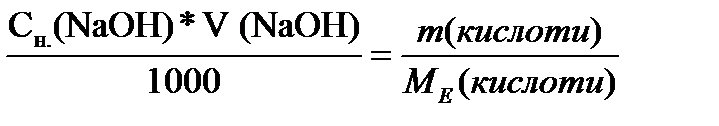
m(кислоти)= 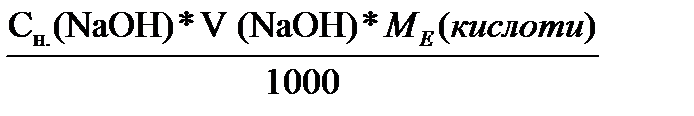
m(кислоти в пробі)=
Вміст кислоти(в грамах на літр) у харчовому напої розраховуємо згідно формули:
m(кислоти в напої) = (m(кислоти в пробі)*1000)/Vпроби в мл.
m(кислоти в напої) =
9. Зробити висновок і захистити роботу у викладача.
Оцінка роботи студента викладачем:
Заняття № 14. Практична робота.
Тема: Кондуктометрія, кондуктометричне титрування, вольт-амперометрія та полярографія.
Мета: Засвоїти основи кондуктометрії, кондуктометричного титрування та вольт-амперометрії.
Теоретичні основи:
На чому базується метод кондуктометрії? ____________________________
________________________________________________________________
________________________________________________________________
На чому базується метод кондуктометричного титрування?
________________________________________________________________
________________________________________________________________
Що таке питома та еквівалентна електропровідності розчинів?
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
В яких координатах будують криву кондуктометричного титрування?
________________________________________________________________
Аналіз кривої кондуктометричного титрування слабкої кислоти сильною основою.
Аналіз кривої кондуктометричного титрування сильної кислоти сильною основою.
Встановлена залежність питомої електропровідності HCl від концентрації:
| С, моль/л | 0,4 | 0,7 | 1,5 | 3,0 | 6,0 | 7,0 | 8,0 |
| æ, Ом-1см-1 | 2,5 | 3,8 | 5,0 | 8,0 | 12,3 | 14,0 | 15,0 |
Порахуйте титр розчину, електрична провідність якого дорівнює 7,0 Ом-1.
Опишіть суть полярографії, та амперметричного титрування.
Заняття № 15. Лабораторна робота.
Тема: Кондуктометричне титрування. Визначення вмісту хлоридної та ацетатної кислот при кондуктометричному титруванні їх суміші.
Мета: Засвоїти основи кондуктометричного титрування.
Хід роботи.
Розчин суміші хлоридної та ацетатної кислот піпеткою на 25,0 мл переносимо у хімічну склянку місткістю 100 мл. Склянку ставимо на магнітну мішалку і включаємо перемішування розчину. У розчин занурюємо електроди від приладу для високочастотного титрування і починаємо процес титрування додаючи по 1 мл 0,100 н. розчину NaOH. Кожного разу вимірюємо струм, який проходить через електроди.
| V NaOH (мл) | I мкА | V NaOH (мл) | I мкА | Розраховуємо вміст кислот у суміші. |
Будуємо графік титрування суміші кислот.
Висновки:
Заняття № 16. Практична робота.
Тема: Хроматографія.
Мета: Засвоїти основи хроматографії.
Теоретичні основи:
На чому базується метод хроматографії? ____________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Що таке паперова та тонкошарова хроматографія? _____________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Що таке газова та рідинна хроматографія ____________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Принцип роботи та основні вузли хроматографів ______________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Намалюйте типову хроматограму.
Що фіксується при якісному та кількісному хроматографічному аналізі.
________________________________________________________________
________________________________________________________________
________________________________________________________________
Висновки:
Заняття № 17. Лабораторна робота.
Тема: Визначення вмісту органічних розчинників хроматографічним способом.
Мета: Засвоїти основи газової та рідинної хроматографії.
Хід роботи.
Хроматографічним способом аналізу скористаємось для визначення концентрацій ацетону, бензолу, толуолу та ксилолу в повітрі робочої зони.
1. Спочатку будуємо калібрувальний графік. Для цього мікрошприцем в закриту банку на 1 літр вносимо по 1 мікролітру ацетону, бензолу, толуолу та ксилолу. При цьому у банці створиться концентрації цих речовин (враховуємо їх густини):
Ацетон 70,5 мг/м3 Бензол 78,5 мг/м3
Толуол 77,4 мг/м3 Ксилол 78,6 мг/м3
2. Відбираємо з банки 1 мл зразка і вводимо в хроматограф. Використовуємо колонку з сорбентом Карбовакс 20М. Температура випарника 150°С, температура колонки 100°С, температура детектору 160°С. Газ носій азот ОСЧ (особливої чистоти), швидкість подачі 30 мл за хвилину. Для забезпечення горіння пальника в детекторі ПІД подається суміш водню і стисненого повітря з швидкостями 30 та 300 мл за хвилину. При виході з хроматографічної колонки аналізуємих речовин змінюється інтенсивність іонізаційного струму в детекторі, що реєструється у вигляді хроматографічного піку.
Реєструється час виходу піку – якісна характеристика речовини та інтенсивність піку – кількісна характеристика речовини.
Таблиця1: Дані для побудови калібрувального графіку
| Речовина | концентрація | Час виходу піку | Площа піку |
| Ацетон | |||
| Бензол | |||
| Толуол | |||
| Ксилол |
Таблиця2: Дані для побудови калібрувального графіку
| Речовина | концентрація | Час виходу піку | Площа піку |
| Ацетон | |||
| Бензол | |||
| Толуол | |||
| Ксилол |
Таблиця3: Дані для побудови калібрувального графіку
| Речовина | концентрація | Час виходу піку | Площа піку |
| Ацетон | |||
| Бензол | |||
| Толуол | |||
| Ксилол |
Побудувати чотири калібрувальні графіки для ацетону, бензолу, толуолу та ксилолу.
Отримуємо у викладача зразки для аналізу.
В результаті аналізу та обробки хроматограми отримали такі дані
Зразок №1 для аналізу: Зразок № 2 для аналізу
| Час виходу піків | Інтенсивність піків | ||
По калібрувальним графікам визначаємо наявність та концентрації ацетону, бензолу, толуолу та ксилолу в повітрі робочої зони.
Зразок №1 для аналізу: Зразок № 2 для аналізу
| Речовина | Концентрація | Речовина | Концентрація |
Зробити висновок
САМОСТІЙНА РОБОТА
РЕФЕРАТ НА ТЕМУ: ________________________________________________
_________________________________________________________________
_________________________________________________________________
Не нашли, что искали? Воспользуйтесь поиском: