
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ІІ. Алу және синтездеу әдістері
Сонда этилен молекуласында 5σ және 1π байланыстар бар. Байланыс бұрышы 120 0, көміртек атомдарының арақашықтығы -0,134 нм, байланыс бұзу энергиясы 606 кДж/моль.
Этиленнің радикалы- СН2=СН-винил деп аталады.
Аталуы:
1) алдымен қос байланыс бар ұзын тізбегін алады;
2) номерлеуді қос байланыс жақын орналасқан жерден бастайды;
3) қос байланыстың орнын ең соңында белгілейді;
СН3
1 2 3 4 5

 Мысалы: СН3 - С = СН – С - СН3
Мысалы: СН3 - С = СН – С - СН3


СН3 СН3
2,4,4 үшметил пентен-2
Номенклатура және изомерия. Алкендердін атаулары сәйкес келетін алканның ан жұрнағын ен жұрнағына ауыстырылып жасалады. Тізбекті нөмірлегенде негізгі тізбектің құрамына міндетті түрде қос байланыс кіруі қажет. Тізбекті қос байланыс жақын жағынан нөмірлейді. Тізбектін атауынан кейін дефис арқылы қос байланыстың орналасқан жерінің цифрын қояды.
СН3 – СН = СН – СН3 Н3С—СН=СН2
бутен –2 пропен –1
Изомериясы.
Алкендерге 4 түрлі изомерия тән:
1) көміртек қаңқасы: С5Н10
1 2 3 4 5 1 2 3 4
 СН2=СН-СН2-СН2-СН3 СН2=С-СН2-СН3
СН2=СН-СН2-СН2-СН3 СН2=С-СН2-СН3
Пентен-1
СН3 2-метил бутен-1
2) қос байланыстың әртүрлі орналасуы:
1 2 3 4 5 1 2 3 4 5
СН2=СН-СН2-СН2-СН3 СН3-СН=СН-СН2-СН3
Пентен-1 пентен-2
3) класс аралық:


 СН2=СН-СН2-СН2-СН3 Н2С СН2
СН2=СН-СН2-СН2-СН3 Н2С СН2
Пентен-1

 Н2С СН2
Н2С СН2
СН2 циклопентан
4) геометриялық (кеңістік) –цис-транс-изомерия (лат.cis-бір жақты; trans-әр жақты)
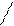

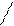
 Н3С СН3 Н СН3
Н3С СН3 Н СН3


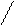 С=С С=С
С=С С=С
 |
Н Н СН3 Н
Цис-изомер тарнс-изомер

Алу жолдары.
Рационалдық номенклатура бойынша алкендерді олардың қарапайым -өкілі этиленнің туындысы ретінде қарастырады.
СН3 – СН = СН – СН2 – СН3 СН3 – С = СН – СН2 – СН3
 метилэтилэтилен
метилэтилэтилен
СН3
диметилэтилэтилен
Алкендерден түзілген кқміртекті радикалдар-“енил” жқрнағын алады. Бірақта қарапайым алкенил радикалдарға тривиалды (қалыптасқан) атауларды қолдануға болады:
СН3

Н2С=СН- Н2С=СН – СН2 - Н2С=С –
винил аллил изопропенил
(этенил) (2 пропенил) (1 метилэтенил)
ІІ. Алу және синтездеу әдістері
Алкендер табиғатта кездеспейді, олар мұнайды біріншілік және екіншілік қайта өңдегенде және тас көмірді кокстау сатыларында пайда болады.
1. Спирттерден катализаторлар қатысында (Н+, АІ2О3, ұшқыш емес карбон қышқылдары, мысалы Н2С2О4) дегидратация реакциясы арқылы.
Н3С–СН2–ОН→ Н2С = СН2 + Н2О
Температура: 350-400 0С
Сутегі сутектері көбірек көміртегі атомынан айырылады (Зайцев ережесі):
СН3 – СН – СН2 – СН3 → СН3 – СН = СН – СН3 + Н2О
|
ОН
Реакция элиминирлеу (жұпты айырылу) механизмі бойынша жүреді.
2. Алкилгалогенидтерге күшті сілтімен (NaOC2H5, NaOH спирттегі ерітіндісі) әсер еткенде НГ бөлініп қос байланыс пайда болады
Н3С–СН2– СН2–СІ + NaOC2H5 ® Н3С–СН=СН2 + C2H5 + NaСІ
Н3С–СН2– СН2–СІ + NaOH(спирт) ® Н3С–СН=СН2 + H2О + NaСІ
Реакция элиминирлеу (жұпты айырылу) механизмі бойынша жүреді.
3. 1,2-дигалоидтуындылардан активті металмен (Zn, Mg) әсер етіп алуға болады
R-CHCI-CHCI-R/ + Zn ® R-CH=CH-R/ + ZnCI2
4. Виттиг реакциясы: альдегид карбонилының оттегін метилен тобына фосфинметилендерді (СН2=РR3/) қолданып алмастыру
R-CH=О + СН2=РR3/® R-CH=CH2 + О=РR3/
Реакция аралық циклды қосылыс түзілуі арқылы өтеді
5. Оксоқосылыстарға метиленгалогенидтермен және магниймен бірге әсер еткенде алкендер пайда болады (Каинелли, Бертиани, Грессели, 1967)
СН2Br2 + R-CO-R/ + Mg ® MgBr- СН2-RR/CO-MgBr® СН2=CRR/ + (MgBr)2O
6. Өте активті емес катализатордың қатысында үшілік байланысты гидрлеу (Pt, Pd жартылай темірмен активсіздендірілген)
7. Алкандардың крекингі
500° С
 СН3 -СН3 СН2 =СН2 + Н2
СН3 -СН3 СН2 =СН2 + Н2
этан этилен

 460° С СН-СН=СН2
460° С СН-СН=СН2
 СН3-СН2-СН3 пропилен
СН3-СН2-СН3 пропилен
пропан
 СН2 =СН2 +СН4
СН2 =СН2 +СН4
этилен
мұнай өнімдерін немесе серік газдарды өңдеуде (крекениг)
1) Н3С-СН2-СН2-СН3 →Н2С=СН-СН2-СН3 +Н2
Бутен-1
2) Н3С-СН2-СН2-СН3 →Н3С-СН=СН-СН3 +Н2
Бутен-2
катализатор:Cr2O3
температура:700 0С
зертханада:
1) алкандардың галоген туындысының спирттік ортада сілтілермен әрекеттеседі.
 СН2-СН2→Н2С=СН2+KCl +Н2O
СН2-СН2→Н2С=СН2+KCl +Н2O
Cl H

 K OH
K OH
ІІІ Физикалық қасиеттері:
1) Физикалық қасиеттері гомологтық қатарда белгілі заңдылықпен өзгереді;
2) С2Н4, С3Н6, С4Н8 –газдар;
С5Н10- С17Н34-сұйықтар;
С18Н36- әрі қарай қатты заттар;
3) Молекулярлық массалары өскен сайын қайнау, балқу температурасы өседі;
4) Тармақталмаған қанықпаған көмірсутектердің қайнау температурасы тармақталғандарға қарағанда жоғары температурада қайнайды;
5) Цис-изомерлердің қайнау температурасы транс-изомерлерге қарағанда жоғары;
6) Суда ерімейді, органикалық еріткіштерде ериді;
Химиялық қасиеттері:
Химиялық қасиеті  -байланыс болуымен ерекшеленеді. Қанықпаған көмірсутектер болғандықтан оларға қосылу реакциялары тән.
-байланыс болуымен ерекшеленеді. Қанықпаған көмірсутектер болғандықтан оларға қосылу реакциялары тән.
Қосылу реакциялары:
1) сутекті қосып алу- гидрлену реакциясы.
СН2=СН2+Н2→СН3 - СН3
этен этан
Катализатор: Ni, Pt,Pd.
2) Галогендерді қосып алу- галогендеу реакциясы:
СН3 - СН2=СН2+Br2→СН3СН2Br-СН2Br
пропен 1,2 дибромпропан
Галогендерді қосып алу реакциясы мына қатарда F2 > Cl2> Br2 > J2 төмендейді.
Фтормен қопарыс береді.
3) Галогенсутектерді қосып алу- гидрогалогендеу реакциясы:
СН3 - СН=СН2+НCl →СН3 –СНCl-СН3 – бұл реакцияның жүруін зерттеп, сутек атомы – сутек көп көміртек атомына, ал галоген-сутек атомы аз көміртек атомына қосылады,оны Марковников ережесі деп атайды.
4) Су молекуласын қосып алу- гидратация. Гидратация реакциясында Марковников ережесі бойынша жүреді:
СН3 - СН=СН2+Н-ОН→СН3 –СНОН-СН3
пропонол -2
5) Күкірт қышқылын қосып алу- реакция нәтижесінде алкилсульфат алынады.
СН3 - СН=СН2+Н-SO3-OH→СН3 – СН-СН3
 SO3OH
SO3OH
пропилкүкірт қышқылы
II. Этилен туындыларына изомерлену реакциялары тән:
1) қос байланыс орны ауысу:
Н3С - СН2- СН=СН2→СН3 – СН=СН-СН3
бутен-2
2) көмірсутек қаңқасының өзгеруі:
 СН3 – СН2- СН=СН2→СН3 – С-СН2
СН3 – СН2- СН=СН2→СН3 – С-СН2
СН3 - 2 метил пропен
реакциялар жоғары температурада және катализатор қатысында жүреді.
III. Полимерлену реакциялар тән.
1)  -байланыс тың үзілу нәтижесінде полимерлену реакциялары жүреді:
-байланыс тың үзілу нәтижесінде полимерлену реакциялары жүреді:
СН2=СН2→ - [ СН2-СН2] n →[ СН2-СН2] n →[ СН2-СН2]
этилен полиэтилен


 2)СН3 – СН=СН2→[ СН-СН2] - [ СН-СН2] →[ СН-СН2] n
2)СН3 – СН=СН2→[ СН-СН2] - [ СН-СН2] →[ СН-СН2] n
СН3 СН3 СН3 – полипропилен.
Катализатор: (С2Н5)3Al және TiCl4)
IV. Тотығу реакциялары:
1) жану реакциясы:
СН2=СН2 +3О2→2СО2+2Н2О
2) 
 2СН2=СН2 +3О2→2Н2С - СН2
2СН2=СН2 +3О2→2Н2С - СН2
О
О2 –ауа қатысында этилен оксиді- этиленді Н.Бехер 1669 жылы алған.
Катализатор:Ag
Температура: 3500С
3) KMnO4-ерітіндісімен тотығады-Вагнер реакциясы:
3СН2=СН2 +2KMnO4+4Н2О →3СН2 - СН2 +2MnO2 +2KОН
 |  |
ОН ОН-этиленгликоль
3С-22Н4+2KMn+7O4+4Н2О →3С-12Н6О2+2Mn+4O2 +2KОН
 2С-22 -2е →2С-1 3
2С-22 -2е →2С-1 3
Mn+7+3е →Mn+4 2
KMnO4 күлгін түстен қоңыр түсті MnO2 тотықсызданады. Бұл этиленді көмірсутекті қосылыстардың сапалық реакциясы.
Реакция күкірт қышқылының (H2SO4) қатысында былай да жүруі мүмкін:
5СН2=СН2 +4KMnO4+46Н2SО4 →5СН3СООН+MnSО4 +2K2SО4+6Н2О
сірке қышқылы
 2С-22 -4е →2С0 5
2С-22 -4е →2С0 5
Mn+7+5е →Mn+2 4
IV. Отдельные представителя алкенов. Алкены широко применяются в химической промышленности как сырьё для производства низко- и высокомолекулярных соединений.
Этилен — бесцветный газ, малорастворимый в воде; применяют для синтеза этилового спирта, стирола, полиэтилена, и т. д.
Пропилен выделяют из газов нефтепереработки, является сырьём для получения изопропилбензола, глицерина, акрилонитрила, синтеетического каучука, полипропилена и т. д.
Бутилен (бутен-1 и бутен-2), изобутилен (2-метилпропен-1) выделяют из газов пиролиза и крекинга нефти. Бутен-1 применяют для получения бутадиена-1,3 и изооктана.
Қолданылуы:
Этиленді: 1) этил спиртін;
2) галогенді туындыларын;
3) этилен оксидін;
4) полиэтилен алуда:
5) және өсімдіктердің өсуін тездетеді.
Пропиленді:1) ацетон;
2) фенол;
3) глицирин;
4) изопропилспиртін:
5) полипропилен т.б. алуда;
Бутилен: 1) дивинил;
2) изооктан;
полимерлер т.б. алуда
| <== предыдущая лекция | | | следующая лекция ==> |
| III. УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ. | | | Синдромы клапанных пороков сердца |
Не нашли, что искали? Воспользуйтесь поиском: