
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
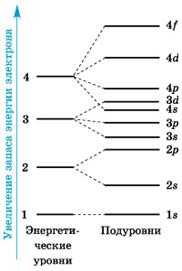
Правила описания химических элементов по энергетическим уровням и подуровням.
1. Каждый уровень начинается с s -подуровня.
2. Количество подуровней на уровне равно номеру уровня.
3. На одной орбитали может быть не более двух электронов и обязательно с противоположными спинами.
4. Энергетический подуровень заполняется сначала электронами одного спина, пока на каждой орбитали энергетического подуровня не будет по одному электрону, лишь потом заполняются противоположными спинами.
5. p -подуровень заполняется на своём энергетическом уровне и заканчивает его.
6. d -подуровень начинает заполняться на следующем энергетическом уровне после s -подуровня данного энергетического уровня.
7. f -подуровень начинает заполняться через уровень после d -подуровня предыдущего уровня в таком порядке: сначала один электрон на d -подуровень, затем полностью заполняется f -подуровень и потом d -подуровень дозаполняется до конца.
8. Число электронов химического элемента соответствует порядковому номеру данного химического элемента (когда он электронейтрален).
9. s - и p -электроны составляют наружный энергетический уровень, а d - и f -электроны – внутренний энергетические уровень.
10. У d -элементов электроны могут переходить с s -подуровня на d -подуровень.
11. g -подуровень должен начинаться заполняться через два уровня.
12. j -подуровень должен начинаться через три уровня.
13. q -подуровень должен начинаться через четыре уровня.
Заполнение электронами энергетических подуровней и уровней с учетом энергии (по правилам):
 |  |  |  |  | |||||||||
 |  | ||||||||||||





 1s2 2s2 2p6 3s2 3p6 3d10 4s2 3d10 4p6 4d10 4f14 5s2 4d10 5p6 5d10 5f14 6s2 5d10 4f14 6p6 6d10 7s2 6d10 5f14
1s2 2s2 2p6 3s2 3p6 3d10 4s2 3d10 4p6 4d10 4f14 5s2 4d10 5p6 5d10 5f14 6s2 5d10 4f14 6p6 6d10 7s2 6d10 5f14
 |  | ||||
 |
1 2 3 4 5 6 7

П е р и о д
Т. е. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d10 4f14 6p6 7s2 6d10 5f14

Или
|
Вопросы: (для контроля знаний)
- Как формулировал периодический закон Д. И Менделеев и его современная формулировка? В чем отличие?
- Охарактеризуйте атом.
- Что образуется при изменении частиц атома? Дайте определение образующимся идам атома.
- Что такое орбиталь? Какие виды орбиталей выделяют? В чём между ними разница?
- Что такое энергетические уровни и подуровни?
- Какая электронная формула, какое имеется строение по энергетическим ячейкам, сколько электронов на внешнем энергетическом уровне у элемента:
а) 51Sb0;
б) 61Pm0;
в) 74W0.
Список используемых источников:
1. «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г.
2. http://www.1variant.ru/2011-10-27-22-57-07/51-2012-04-08-12-21-19/318-2012-08-10-21-59-47.html
3. http://onx.distant.ru/posobie-1/chemistry/part_4.htm
4. http://www.hemi.nsu.ru/ucheb145.htm
5. http://interneturok.ru/chemistry/11-klass/bstroenie-atoma-periodicheskij-zakonb/stroenie-atoma
6. http://www.hemi.nsu.ru/ucheb125.htm
7. http://www.hemi.nsu.ru/ucheb126.htm
Не нашли, что искали? Воспользуйтесь поиском: