
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Поняття та терміни фізичної хімії, що стосуються сорбційних процесів
Іонообмінники, іонообмінні матеріали та іоніти – синоніми; іонообмінні смоли
Іони – електрично заряджені частки речовини, які утворені з молекул або атомів внаслідок втрати або приєднання електронів. + та -. Властивості іонів визначаються знаком та величиною заряду, розмірами та властивостями електронної оболонки. Є хімічно активними частками, які вступають в реакції.
Хімічні реакції – перетворення одного або декількох вихідних речовин (реагентів) у відмінні від них за хімічним складом та будові речовини (продукти реакції). Хім. реакції відображують за допомогою хімічних рівнянь, які стехіометрично (кількісно) визначають співвідношення між реагентами та продуктами: naA+nbB=ncC+ndD – стехіометричне рівняння
Основні типи хім. реакцій: заміщення, приєднання, розділення та видалення, обміну.
Електроліти та неелектроліти. Речовини поділяють на електроліти (утворюють в розчині іони, які незалежно переміщуються. Розчини електролітів хімічно активні, іони легко вступають у взаємодію, н-д, моря, океани (концентрація солі 0,5Н) та неелектроліти. Головна відзнака – розчини електролітів пропускають електричний струм, здатні до дисоціації у воді.
Електролітична дисоціація – повний або частковий розпад розчиненої речовини на іони. За здатністю до дисоціації в холодній воді електроліти поділяють на сильні та слабкі. Сильні – в розчинах будь-яких концентрацій містяться практично у вигляді іонів. При підвищенні параметрів води більшість типових сильних електролітів стають слабкими.
Сильні електроліти (кислоти, основи, деякі солі) при t=15…25 оС повністю іонізовані і ЗДМ до них не можна застосовувати.
В розчинах слабких електролітів встановлення рівноваги між іонами та молекулами регулюється константою дисоціації або константою рівноваги.
Для реакції В2А«2В++А2- Кд=  , де СВ,СА,См – відповідно концентрації іонів та недисоційованих молекул електроліту.
, де СВ,СА,См – відповідно концентрації іонів та недисоційованих молекул електроліту.
Ступінь дисоціації – дорівнює відношенню кількості дисоційованих молекул до загальної кількості молекул
Система – тіло або група тіл, що взаємодіють.
Фаза – фізично однорідне тіло (тотожне за хімічним складом, т/д властивостями) або сукупність таких тіл.
Система, яка складається з однієї фази без поверхней розділу наз. гомогенною (гомеофазною), з декількох, min2 – гетерогенною (гетерофазною). Н-д, вода утворює зі льодом та парою 3-х фазну систему.
Між різнорідними частинами, фазами гетерогенної системи існують поверхні – межі розділу фаз. Кожна фаза в кожний окремий момент часу характеризується певним т/д станом, тобто складом, Т, р, V. Розчин – CVT, газ - рVT
Гетерогенна фаза може знаходитись в рівноважному або нерівноважному стані. При рівноважному стані її склад та т/д параметри в часі залишаються постійними. Процес хімічної взаємодії фаз гетерогенної системи закінчується встановленням певного рівноважного розподілення речовин: wпрям=wзвор.
Фази можуть обмінюватись компонентами – речовинами, які здатні існувати ізольовано.
Протікання реакцій в часі описується законами хімічної кінетики: швидкість, залежність від температури.
Всі органічні сполуки поділяють на класи, які визначаються наявністю в їх складі функціональних груп. Ф.г – група атомів, яка зумовлює характерні хімічні властивості даного класу сполук. До ф.г. належать: -ОН, -СНО, -СООН, -NO2, -NH2 тощо.
Вуглеводні не мають ф.г.
Група атомів органічної сполуки, яка може переходити в молекулу продукту не змінюючись, називається радикалом R, наприклад, метильний радикал –СН3.
Карбонові кислоти містять ф.г. СООН: мурашина, оцтова, валеріанова, щавлева.
2 Інтерполяція, екстраполяція, диференціювання та інтегрування
| Графічна інтерполяція здійснюється безпосередньо відліком за кресленням (з врахуванням його масштабу) значення у при заданому значенні х (або х при даному у) в тих же межах, в яких проводяться вимірювання. Для отримання достатньо надійних результатів на ділянках кривих з перегинами і в особливості з різко вираженим екстремумом необхідно мати на них достатньо близько розташовані точки. Приклад математичної інтерполяції | 
|
| Графічна екстраполяція проводиться продовженням кривої за межами дослідних даних. Вона достатньо надійна, якщо вивчена залежність справедлива і поза межами проведених вимірювань. Якщо підстав для цього нема, то вона дає тим менш точні результати, чим більше виходить за межі експерименту. Порівняно точна екстраполяція може дати надійні результати лише при плавному ході кривої та невеликій її кривизні. | 
|
Для графічного диференціювання необхідно провести в даній точці дотичну до кривої та у відповідності до того, що  , визначити тангенс кута α, що утворюється дотичною з позитивним напрямком осі х. При визначенні похідна визначається як відношення відповідних катетів допоміжного трикутника, причому довжина кожного повинна бути виражена в одиницях масштабу. , визначити тангенс кута α, що утворюється дотичною з позитивним напрямком осі х. При визначенні похідна визначається як відношення відповідних катетів допоміжного трикутника, причому довжина кожного повинна бути виражена в одиницях масштабу. 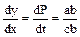
| 
|
| Графічне інтегрування зводиться до визначення площі під кривою, що обмежена двома координатами (н-д, ординатами х1 та х2). Звичайно вдаються до розбивки всієї площі за допомогою ряду паралельних прями х на вузькі смужки рівної ширини, вважаючи їх трапеціями (чи іншими фігурами). Тоді загальну площу трапецій можна прийняти рівною іскомій площі. Отриманий результат треба перерахувати з геометричних розмірів (н-д, квадратні сантиметри) в одиниці вимірювання у відповідності з ціною поділки масштабів. | 
|
Не нашли, что искали? Воспользуйтесь поиском: