
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теориялық бөлім
Зертханалық жұмыс
«Күкірт қышқылы ерітіндісінде мырыштың коррозиялану жылдамдығына контактінің әсері»
Жұмыстың мақсаты: 1. Металдардың потенциалын анықтау әдістерімен танысу.
2. Коррозия үрдістерінің жылдамдығына әр түрлі металдар контактілерінің әсерін зерттеу.
Теориялық бөлім
Mg, Al және т.б. кейбір металдар кей жағдайларда коррозияға төзбейді, алайда, кейбір жағдайларда тәжірибеде олар жәй коррозияға түседі де құрамды материалдар ретінде қолданылуы мүмкін. Коррозия жылдамдығына әр түрлі факторлардың әсерін дұрыс бағалау үшін жүйенің тепе теңдік күйі туралы білу және электрод арқылы тоқ өткенде оның тепе теңдік күйі бұзылатынын ескеру керек. Микроэлемент жұмысы кезінде электр тогы өтуі потенциалдары ішкі токтың шамасы мен бағытына тәуелді өзгеретін катод және анодтың бастапқы потенциалдар айырымына негізделген. Микрогальваникалық тізбек ажырағанда коррозия тогының мәні Ом заңы бойынша былай өзгереді:
 (1)
(1)
 катодтың қалыпты потенциалы
катодтың қалыпты потенциалы
 анодтың қалыпты потенциалы
анодтың қалыпты потенциалы
R - ом қарама қайшылығы
Тізбек ажырағаннан кейін коррозия тогының шамасы бірден төмендейді де біраз уақыт өткен соң тұрақты мәнге ие болады, себебі бұл жағдайда ом қарама қайшылығының мәні аз және тұрақты, коррозия тогының азаюын тек бастапқы потенциалдар айырымымен, яғни олардың өзгерісінің азаюымен ғана түсіндіруге болады.
| Тоқ өтуі нәтижесінде потенциалдардың мұндай өзгерісін полярлану деп атайды. |
Анодты полярлануды туғызатын себептерге байланысты 3негізгі жағдайды бөліп көрсетеміз:
- Концентрациялы полярлану – бұл анодты полярланудың анодтық аумақтағы концентрацияның ұлғаюына әкеп соғатын электролит ерітіндісіндегі метал иондарының диффузиясының аздаған жылдамдығын тудыратын түрі.
Металдардың полярлануының шектен тыс кернеуі.
Егер анодты үрдіс кезінде:
Me+e + nH2O=Me+ + nH2O + e ерітіндіге түсетін метал иондарының шығыны электрондар ағынына ілесе алмаса, металдар потенциалы кері жағдайға ауысады.
Анодты пассивтілік – бұл метал бетіне пассивті қабаттардың пайда болу үрдісі. Анодты үрдіс анодты пассивтіліктің пайда болуы нәтижесінде жиі тоқтап қалады. Бұл арқылы азот қышқылындағы және де тұздың аэрирлі ерітнділеріндегі алюминий мен таттанбайтын болаттың коррозияға төзімділігінің айрықша жоғары деңгейін түсіндіруге болады. Анодтағы фазалық қорғаныш қабаттары метал бетіндегі шөгінділер нәтижесі ретінде пайда болуы мүмкін.
Катодты полярлану катодты реакцияның кернеулігіне негізделген – бұл концентрациялы полярланудың бәсеңдеуі, яғни катодтағы бастапқы не ақырғы реакция өнімдерінің тартылыс және тебіліс жылдамдықтарының жетіспеушілігі. Катодты деполярланудың негізгі түрлері бар:
- Иондармен деполярлану
- Катиондардың жіктелуі (сутегі иондары не асыл металдар)
H++e®H®1/2H2; Ag++e®Ag
- Бейтарап молекулалардың тотықсыздануы O2+4e+2H2O®4OH-
Cl2+2e®2Cl-
Анодты полярлану – бұл анодты тоқ өткен кездегі анод потенциалының қалыпты жағдайға ауысуы.
Катодты полярлану – катодты тоқ өткен кездегі катод потенциалының кері жағдайға. Электродтардың полярлануының азаюы деполярлану деп аталады.
Тәжірибедегі коррозияның жиі кездесетін түрі – бұл сутегі бөлінетін тотықтырғыш емес қышқыл ерітінділеріндегі жүретін үрдістер – сутекті деполярлану немесе тұздардың бейтарап ерітінділері. Кейде бұл екі үрдіс те параллель орындалады. Сутекті деполярлану берілген жағдайларда металдардың тепе теңдік потенциалы сутегіне қарағанда кері болғанда ғана жүзеге асады.
Бейтарап жағдайда pH=7, t=250C және Р=1,013 105 н/м2 (1 атм.)
Сутегі электродының тепе теңдік потенциалын Нернст формуласы бойынша анықтау оңайға түседі:

Анодты не катодты полярлануды кішірейтетін немесе төмендететін заттар анодты (катодты) деполярлаушы деп аталады.
Егер коррозия үрдісінің сутекті деполярлануы үшін қажетті шарттар орындалмаса және көмірқышқыл газының ерітіндісінде деполярлаушы реакция ретінде негізгі рөлді катодтағы көмірқышқыл газының тотықсыздануы, яғни көмірқышқылды деполярлану үрдісі атқарады. Көмірқышқылды деполярланудың мүмкіншілігін Нернст формуласы бойынша есептеуге болады, себебі үрдіс тек берілген жағдайдағы металдың тепе теңдік потенциалы көмірқышқыл электродының тепе теңдік потенциалынан кері болған кезде ғана орындалады.
Көмірқышқылды деполярлану бірнеше сатылардан өтеді. Қышқыл ерітінділер үшін көмірқышқылды деполярлануды былай көрсетуге болады:
O2+4H++4e®2H2O
Бейтарап және сілтілі орталар үшін көмірқышқылды деполярланудың суммалық реакциясының сипатталуы:
O2+2H2O+4e®4OH-
Eобр=(jк)обр-(jа)обр – электрохимиялық коррозия үрдісі анодты аймақтан металдың катодты аймағына, және катодты аймақтан металддың катодты аймағына, не катодты аймақтан электролиттегі анодты аймаққа екі аймақта да полярлануды туғыза отырып электр тогының өтуі. Күкірт қышқылындағы мырыш пластинкаларының жүктемелері оның бетінде пайда болған микрожұптардың жұмысы нәтижесінде ериді. Бұл микрожұптардың микрокатодтары болып мырыштағы негізгі металға қарағанда әлдеқайда жармды қоспалар табылады. Бұл микрокатодтардың бетінен газ түзуші сутегі бөлініп шығады. Егер күкірт қышқылына жүктелген мырыш үлгілерін әлдеқайда электрлік металға жанастырса, онда мырыш осы микрожұптардың жұмысының нәтижесінде ери бастайды. Екінші электрод әсерінен мырыш коррозиясының жылдамдығы электрод пен микрожұптар арасымен өтетін ток күшімен анықталады.

 - мырыштың потенциалы
- мырыштың потенциалы
 - катодтың потенциалы
- катодтың потенциалы
R - универсал газ тұрақтысы
 - контактіде мырышпен бірге болатын металдың потенциалы
- контактіде мырышпен бірге болатын металдың потенциалы
Rom –электролиттің омдық қарама қайшылығы.
Ом қарама қайшылығы (Rom) және мырыш анодының потенциалы (φа) тұрақты болған кезде элементтің ток күші катодтың табиғатына тәуелді болады, яғни екінші металға қондырылған потенциалға φк, ол төмендегі теңдеуді көрсететін берілген ерітіндідегі сутегінің тепе теңдік потенциалы және катодқа бөлінетін сутегінің шектен тыс кернеуі шамаларының мәнімен анықталады (250С кезінде)

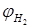 -катодта бөлінетін сутегінің потенциалы
-катодта бөлінетін сутегінің потенциалы
 -сутегі иондарының концентрациясы
-сутегі иондарының концентрациясы
 -берілген ерітіндідегі сутегінің белсенділік коэффициенті
-берілген ерітіндідегі сутегінің белсенділік коэффициенті
 - берілген металдағы сутегінің бөліну кернеуі.
- берілген металдағы сутегінің бөліну кернеуі.
Ерітінді құрамы өзгермегенде және тұрақты температурада СН+ - тұрақты, және контактіде басқа әлдеқайда электрлік металдармен бірге орналасқан мырыштың еру жылдамдығы өзге түрақты жағдайларда, яғни электролит құрамы мен ом қарама қайшылығы тұрақты болғанда мырышпен контактіге түсетін катодты металдағы сутегінің бөлінуінің шектен тыс кернеуінің шамасымен анықталады.
Не нашли, что искали? Воспользуйтесь поиском: