
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
СТЕПЕНЬ ОКИСЛЕНИЯ И ВАЛЕНТНОСТЬ АТОМОВ
Степень окисления (С.О.) – это условный заряд атома в соединении, вычисленный исходя из предложения о чисто ионном характере химической связи. Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обозначают арабскими цифрами со знаком ''+'' или ''-'' и ставят над символом элемента, например: Cl20,K+2O-2, H+N+5O-2
Нулевую степень окисления имеют нейтральные атомы (например, Mg, H2, O2). Для ряда элементов С.О. атомов в соединениях постоянна. К ним относятся:
Элемент С.О.
Li, Na, K, Rb, Cs, Fr, H (кроме гидридов) +1
Be, Mg, Ca, Sr, Ba +2
Al, Sc +3
Галогены в галлидах (МеГх –1) и водород в гидридах (МеНх) -1
О (кроме пероксидов) -2
Пользуясь этими сведениями, можно вычислять С.О. других атомов в соединениях, учитывая, что АЛГЕБРАИЧЕСКАЯ СУММА СТЕПЕНЕЙ ОКИСЛЕНИЯ ВСЕХ АТОМОВ В СОЕДИНЕНИИ ВСЕГДА РАВНА НУЛЮ, А В СЛОЖНОМ ИОНЕ – ЗАРЯДУ ИОНА.
Например, в соединениях FeO, NaFeO2, K2FeO4 С.О. атома железа будет соответственно +2, +3, +6, т.к. С.О. атома кислорода равна -2, натрия и калия - +1, а алгебраическая сумма С.О. всех атомов равна нулю:
Fe+2O-2 Na+Fe+3O2-2 K2+Fe+6O4-2
+2 +(-2)=0 +1+3+2(-2)=0 +1·2+6+4(-2)=0.
Валентность определяется как число химических связей, образуемых данным атомом в соединении.
В простейших случаях валентность атома элемента определяется числом неспаренных электронов в нем, идущих на образование общих электронных пар. Например, в соединениях НС1, СН4, Н2S валентность: С1 - I, C - IV, S - II, т.к. связь в молекулах осуществляется за счет одной, четырёх и двух электронных пар у соответствующего атома (пара электронов при графическом изображении обозначается черточкой).
H―Cl, H―S―H, Н
│
H―C―H
│
H
УПРАЖНЕНИЕ 2. Определите степень окисления атома подчеркнутого элемента в приведенных молекулах или ионах:
K Mn O4, H N O2, P O43-, Cr 2O3. В последнем примере определите так же и валентность подчеркнутого элемента (укажите число химических связей, образуемых данным атомом элемента в соединении).
ОТВЕТ: Для определения С.О. подчеркнутых элементов в приведенных примерах KMnO4, HNO2, Cr2O3, укажем С.О. всех остальных атомов в соединениях и, подсчитав их алгебраическую сумму, найдем С.О. подчеркнутого элемента как величину равную и противоположную по знаку алгебраической сумме С.О. всех остальных атомов.
В K+1MnO4-2 алгебраическая сумма С.О. равна -7, следовательно, С.О. марганца равна +7; в H+1NO2-2, рассуждая аналогично, С.О. азота равна +3; в Cr2O3-2 С.О. хрома равна +3.
В ионе РО43- требуется определить С.О. фосфора. Сумма всех степеней окисления атомов в ионе должна быть равна заряду иона. Тогда, обозначив С.О. фосфора через х и умножив степень окисления кислорода (-2) на число его атомов, составим уравнение
х + (-2)·4 = -3, отсюда х= +5.
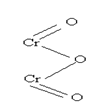 |
В молекуле Cr2O3 хром трехвалентен, т.е. число химических связей, образуемых хромом равно 3:
В приведенной графической формуле электронная пара ковалентной связи обозначена черточкой.
ЗАДАНИЕ 2 (для самоконтроля) Определите С.О. подчеркнутого элемента в следующих примерах:
а) K2MnO4, CrO2-, SnCl4; б) HVO3, CrO42-, CuI2;
в) Na2CO3, PO33-, Fe2(SO4)3; г) K2Cr2O7, NO3-, NH4OH;
д) NH4NO3, CO32-, SnCl4; е) KNO2, SO42-, FeCO3;
ж) NiSO4, AlO2-, Fe(OH)3; з) K2SO3, SnO32-, CaF2;
и) MnO2, SnO22-, Fe2O3.
В каждом последнем примере задания определите так же и валентность подчеркнутого элемента (укажите число химических связей, образуемых данным атомом элемента в соединении).
Не нашли, что искали? Воспользуйтесь поиском: