
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Материальный балансы процессов горения
Теоретической базой для расчётов материального и теплового балансов являются фундаментальные законы сохранения веществ и энергии.
1.1. Расчёт количества воздуха, необходимого для горения веществ
Для практических расчётов принимают, что состав воздуха состоит из 21%кислорода и 79% азота. Таким образом, объёмное соотношение азота и кислорода в воздухе составит:
 (1.1.1)
(1.1.1)
где  - соответственно объёмное (% об.) содержание азота и кислорода
- соответственно объёмное (% об.) содержание азота и кислорода
в окислительной среде.
Следовательно, на 1 м3 (кмоль) кислорода в воздухе приходится 3,76 м3 (кмоль) азота.
Весовое соотношение азота и кислорода в воздухе составляет 23,3% О2 и 76,7% N2. Его можно определить, исходя из:
 (1.1.2)
(1.1.2)
где  -молекулярные массы соотношение азота и кислорода.
-молекулярные массы соотношение азота и кислорода.
Для удобства расчётов горючие вещества разделяют на три типа (табл.1.1.1): индивидуальные химические соединения (метан, уксусная кислота и т.п.), вещества сложного состава (древесина, торф, сланцы, нефть, и т.п.), смесь газов (генераторный газ и т.п.).
Таблица 1.1.1
| Тип горючего вещества | Расчётные формулы | Размерность |
| Индивидуальное вещество | 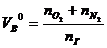 (1.1.3,а) (1.1.3,а)
 (1.1.3,б) (1.1.3,б)
| 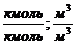

|
| Вещество сложного состава |  (1.1.4) (1.1.4)
| 
|
| Смесь газов |  (1.1.5) (1.1.5)
| 
|
Здесь  -теоретическое количество воздуха;
-теоретическое количество воздуха;  ,
,  ,
,  -количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М – молекулярная масса горючего; V0 – объем 1 кмоля газа при нормальных условиях (22,4 м3); C, H, S, O - весовое содержание соответствующих элементов в составе горючего, %
-количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М – молекулярная масса горючего; V0 – объем 1 кмоля газа при нормальных условиях (22,4 м3); C, H, S, O - весовое содержание соответствующих элементов в составе горючего, % 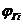 - концентрация I - го горючего компонента, % об.;
- концентрация I - го горючего компонента, % об.;  -концентрация кислорода в составе горючего газа, % об.;
-концентрация кислорода в составе горючего газа, % об.;  - количество кислорода, необходимое для окисления одного кмоля i- го горючего компонента, кмоль.
- количество кислорода, необходимое для окисления одного кмоля i- го горючего компонента, кмоль.
Для определения объёма воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов
 , (1.1.6)
, (1.1.6)
где  - нормальное давление, Па;
- нормальное давление, Па;
Т0 - нормальная температура, К;
V0 - объём воздуха при нормальных условиях, м3;
 - заданное давление, Па;
- заданное давление, Па;
 - заданная температура, К;
- заданная температура, К;
 - заданный объём газа, м3.
- заданный объём газа, м3.
Практический объём воздуха Vв, поступивший в зону горения. Отношение практического объёма воздуха к теоретическому называется коэффициентом избытка воздуха  :
:
 (1.1.7)
(1.1.7)
Разность между практическим и теоретическим объёмами воздуха называется избытком воздуха  :
:
 (1.1.8)
(1.1.8)
Из уравнений (1.1.7) и (1.1.8) следует, что
 (1.1.9)
(1.1.9)
Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле:
 (1.1.10)
(1.1.10)
где  - содержание кислорода в продуктах горения, % об.;
- содержание кислорода в продуктах горения, % об.;
 - теоретический объём продуктов горения.
- теоретический объём продуктов горения.
Для веществ у которых объём продуктов горения равен объёму исходного воздуха (например, углерод), формула (1.1.10) упрощается:
 . (1.1.11)
. (1.1.11)
В случае образования продуктов неполного сгорания (CO, H2, CH4, и др.) формула (1.1.11) приобретает вид:
 (1.1.12)
(1.1.12)
где  - содержание соответствующих веществ в продуктах
- содержание соответствующих веществ в продуктах
горения, % об.
Если содержание кислорода в окислительной среде отличается от содержания его в воздухе, то формулу (1.1.12) можно записать в виде:
 (1.1.13)
(1.1.13)
и соответственно формулу (1.1.13)
 (1.1.14)
(1.1.14)
где  - исходное содержание кислорода в окислительной среде, % об.
- исходное содержание кислорода в окислительной среде, % об.
Часто в пожарно-технических расчётах требуется определить массу воздуха, пошедшего на горение,
 (1.1.15)
(1.1.15)
где  - плотность воздуха, кг/м3.
- плотность воздуха, кг/м3.
Очевидно, что
 (1.1.16)
(1.1.16)
После подстановки постоянных значений в формулу (1.1.16) получим
 (1.1.17)
(1.1.17)
где Р – атмосферное давление, Па;
Т – температура воздуха, К.
Примеры
Пример 1. определить теоретическую массу и объём воздуха, необходимого для сгорания 1 м3 метана при нормальных условиях.
Решение.
Горючее вещество является индивидуальным химическим соединением, поэтому для расчёта его объёма надо пользоваться формулой (1.1.3,а), запишем уравнение химической реакции горения СН4 в воздухе

 .
.
Из уравнения находим  тогда
тогда
 м3/м3 или кмоль/кмоль
м3/м3 или кмоль/кмоль
По формуле (1.1.15) с учётом уравнения (1.1.16) рассчитаем массу воздуха
 кг/м3.
кг/м3.
Пример 2. Определить теоретический объём воздуха, необходимого для горения 1 кг бензола.
Решение.
Горючее – индивидуальное химическое соединение, поэтому для расчёта по формуле (1.1.3,б) запишем уравнение химической реакции горения

найдём  .
.
Молекулярная масса бензола  .
.
Объём 1 кмоля газа при нормальных условиях составляет 22,4 м3
 м3/кг.
м3/кг.
Пример 3. Определить объём и массу воздуха, необходимого для горения 1 кг органической массы состава С – 60%, Н – 5%, О – 25%, N – 5%, W – 5%(влажность), если коэффициент избытка воздуха 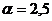 ; температура воздуха 305 К, давление 99500 Па.
; температура воздуха 305 К, давление 99500 Па.
Решение.
Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.1.4)
 м3/кг.
м3/кг.
Из формулы (1.1.7) рассчитаем практическое количество воздуха при нормальных условиях
 м3/кг.
м3/кг.
Находи количество воздуха, пошедшего на горение веществ при заданных условиях горения. Используя формулу (1.1.6), получим
 м3/кг,
м3/кг,
 кг/кг.
кг/кг.
Пример 4. Определить объём воздуха, необходимого для горения 5 м смеси газов, состоящих из 20% - СН4; 40% - С2Н2; 10% - СО; 5% - N2 и 25% - O2, если коэффициент избытка воздуха 1,8.
Решение.
Горючее-смесь газов, поэтому для расчёта объёма воздуха, пошедшего на горение, воспользуемся формулой (1.1.5). Для определения стехиометрических коэффициентов при кислороде  запишем уравнение реакций горения горючих компонентов в кислороде
запишем уравнение реакций горения горючих компонентов в кислороде

тогда
 м3/м3.
м3/м3.
Для горения 5 м3 газовой смеси необходимый теоретический объём воздуха составит 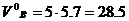 м3. Практическое количество воздуха:
м3. Практическое количество воздуха:
 м3.
м3.
Пример 5. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 м3 воздуха.
Решение.
Для определения коэффициента избытка воздуха по формуле (1.1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты 60.

 м3/кг.
м3/кг.
Тогда коэффициент избытка воздуха по формуле (1.1.7) равен

Горение протекало при недостатке воздуха.
Пример 6. Определить объём воздуха, пошедшего на окисление 1 м3 аммиака, если в продуктах горения содержание кислорода составило 18%.
Решение. Определяем теоретическое количество воздуха, необходимого для горения 1 м3 аммиака:

тогда
 м3/м3.
м3/м3.
Для определения коэффициента избытка воздуха необходимо рассчитать теоретическое количество продуктов горения 1 м3 аммиака
 м3/м3.
м3/м3.
Не нашли, что искали? Воспользуйтесь поиском: