
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Коэффициент избытка воздуха

Объём воздуха, участвующего в процессе горения 1 м3 аммиака, определим из формулы (1.1.7)
 м3/м3.
м3/м3.
Пример 7. Определить объём окислительной среды, состоящей из 60% О2 и 40% N2, необходимый для горения 1 кг изоприлового спирта, если её температура равна 295 К, давление 62,0 кПа.
Решение.
Так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1.1) объёмное соотношение кислорода и азота 40:60=0,67.
Уравнение реакции горения изоприлового спирта

Теоретический объём окислительной среды при нормальных условиях рассчитаем по формуле (1.1.3,б). Молекулярная масса горючего равна 60,
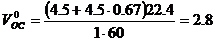 м3/кг.
м3/кг.
Объём окислительной среды при заданных условиях горения определим из формулы (1.1.6)
 м3/кг.
м3/кг.
Пример 8. Определить массу динитротолуола, сгоревшего в герметичном объёме 100м3, если содержание кислорода в продуктах горения составило 12%.
Решение.
Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха, коэффициент избытка определим по формуле(1.1.10).
 .
.
Молекулярная масса горючего равна 183. Теоретический объём воздуха
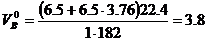 м3/кг.
м3/кг.
Теоретический объём продуктов горения (формула 1.1.15)
 м3/кг,
м3/кг,
 .
.
Практический объём воздуха, пошедший на горение
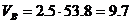 м3/кг.
м3/кг.
Тогда массу сгоревшего динитротолуола Мг определим из соотношения
 м3- полный объём помещения
м3- полный объём помещения
 кг.
кг.
Задание на самостоятельную работу
Задача 1: Рассчитать теоретически необходимое количество воздуха для сгорания m кг вещества при Т=... и Р=.... (жидкость)
| Вариант | Вещество | m, кг | Т, оС | Р, мм рт.ст. |
| Амилбензол | -20 | |||
| Н-Амиловый спирт | ||||
| Анизол | -15 | |||
| Анилин | ||||
| Бутилацетат | -10 | |||
| Бутиловый спирт | ||||
| Бензол | -5 | |||
| Диэтиловый эфир | ||||
| Ксилол | -18 | |||
| Уайт-спирит | ||||
| Этиленгликоль | -16 | |||
| Трет-Амиловый спирт | ||||
| Гексан | -14 | |||
| Метиловый спирт | ||||
| Толуол | -12 | |||
| Стирол | ||||
| Пентан | -8 | |||
| Этанол | ||||
| Амилметилкетон | -6 | |||
| Бутилбензол | ||||
| Бутилвиниловый эфир | -4 | |||
| Ацетон | ||||
| Этиловый спирт | -2 | |||
| Гептан | ||||
| Октан | -25 | |||
| Гексан | 1,5 | |||
| Бутиловый спирт | -6 | |||
| Анилин | 4,6 | |||
| Бензол | -11 | |||
| Ксилол |
Задача 2: Рассчитать теоретически необходимое количество воздуха для сгорания V м3 горючего газа
| Вариант | Горючий газ | V, м3 |
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | ||
| Сероводород | ||
| Бутан | ||
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | ||
| Сероводород | ||
| Бутан | ||
| Метан | ||
| Этан | ||
| Пропан | ||
| Бутан | ||
| Окись углерода | ||
| Ацетилен | ||
| Водород | ||
| Метан | ||
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | 1,5 |
1.2. Расчёт объёма и состава продуктов горения
С целью упрощения расчёта все горючие вещества разделены на три типа: индивидуальные, сложные, смеси горючих газов (табл. 1.2.1).
Таблица 1.2.1
| Тип горючего вещества | Расчетные формулы | Размерность |
| Индивидуальное вещество |  (1.2.1) (1.2.1)
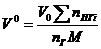 (1.2.2) (1.2.2)
| 

|
| Вещество сложного состава |  (1.2.3) (1.2.3)
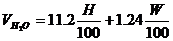 (1.2.4) (1.2.4)
 (1.2.5) (1.2.5)
 (1.2.6) (1.2.6)
| 
|
| Смесь газов |  (1.2.7) (1.2.7)
   (1.2.8) (1.2.8)
| 
|
Здесь  -теоретический объём продуктов горения;
-теоретический объём продуктов горения; 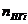 -количество i-го продукта горения в уравнении реакции, кмоль;
-количество i-го продукта горения в уравнении реакции, кмоль;  -количество горючего, кмоль;
-количество горючего, кмоль;  -объём 1 кмоля газа;
-объём 1 кмоля газа;  -молекулярная масса горючего;
-молекулярная масса горючего;  -объём i-го продукта реакции; C, H, S, O, N –содержание соответствующих элементов (углерода, водорода, серы, кислорода и азота) в горючем веществе, % вес;
-объём i-го продукта реакции; C, H, S, O, N –содержание соответствующих элементов (углерода, водорода, серы, кислорода и азота) в горючем веществе, % вес; 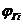 -содержание i-го горючего компонента в газовой смеси, %об.;
-содержание i-го горючего компонента в газовой смеси, %об.; 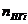 - содержание i-го негорючего компонента в составе газовой смеси, % об.
- содержание i-го негорючего компонента в составе газовой смеси, % об.
Практический (полный) объём продуктов горения состоит из теоретического объёма продуктов горения и избытка воздуха
 (1.2.9)
(1.2.9)
или

 (1.2.10)
(1.2.10)
Состав продуктов горения, т.е. содержание i-го компонента определяется по формуле
 (1.2.11)
(1.2.11)
где 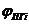 - содержание I - го компонента в продуктах сгорания, % об.;
- содержание I - го компонента в продуктах сгорания, % об.;
 - объём I - го компонента, м3, кмоль;
- объём I - го компонента, м3, кмоль;
 - полный объём продуктов горения, м3, кмоль.
- полный объём продуктов горения, м3, кмоль.
При горении в избытке воздуха в продуктах горения содержится кислород и азот
 (1.2.12)
(1.2.12)
 (1.2.13)
(1.2.13)
где  -теоретический объём азота в продуктах горения, м3, кмоль.
-теоретический объём азота в продуктах горения, м3, кмоль.
 (1.2.14)
(1.2.14)
Примеры
Пример 1. Какое количество продуктов горения выделится при сгорании 1м3 ацетилена в воздухе, если температура горения составила 1450 К.
Решение.
Горючее-индивидуальное химическое соединение (формула 1.2.1). Запишем уравнение химической реакции горения
C2H2+  O2+
O2+ 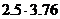 N2=2CO2+H2O+
N2=2CO2+H2O+ 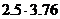 N2
N2
Объём продуктов горения при нормальных условиях
 м3/м3
м3/м3
Объём продуктов горения при 1450 К

 м3/м3
м3/м3
Пример 2. Определить объём продуктов горения при сгорании 1 кг фенола, если температура горения 1200 К, давление 95000 Па, коэффициент избытка воздуха 1,5.
Решение.
Горючее-индивидуальное химическое соединение(формула 1.2.2). Запишем уравнение химической реакции горения
C6H5OH+  O2+
O2+  N2=6CO2+3H2O+
N2=6CO2+3H2O+  N2
N2
Молекулярная масса горючего 98.
Теоретический объём продуктов горения при нормальных условиях
 м3/кг
м3/кг
Практический объём воздуха при нормальных условиях
 м3/кг
м3/кг
Объём продуктов горения при заданных условиях
 м3/м3
м3/м3
Пример 3. Определить объём продуктов горения при сгорании 1 кг органической массы состава: С-55%, О-13%, Н-5%, S-7%, N-3%, W 17%, если температура горения 1170 К, коэффициент избытка воздуха – 1.3.
Решение.
Горючее вещество сложного состава (формулы 1.2.3 - 1.2.6). Теоретический состав продуктов горения при нормальных условиях
 м3/кг
м3/кг
 м3/кг
м3/кг
 м3/кг
м3/кг
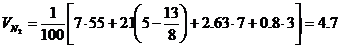 м3/кг
м3/кг
Полный теоретический объём продуктов горения при нормальных условиях
 =1+0,8+0,05+4,7=6,55 м3/кг
=1+0,8+0,05+4,7=6,55 м3/кг
Практический объём продуктов горения при нормальных условиях
 =6,55+0,269
=6,55+0,269  (1,3-1)=6,55+1,8=8,35 м3/кг
(1,3-1)=6,55+1,8=8,35 м3/кг
Практический объём продуктов горения при температуре горения
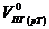 =
=  м3/кг.
м3/кг.
Пример 4. Рассчитать объём продуктов горения при сгорании 1м3 газовой смеси, состоящей из С3Н6-70%, С3Н8-10%, СО2-5%, О2-15%, если температура горения 1300 К, коэффициент избытка воздуха – 2,8. Температура окружающей среды 293 К.
Решение.
Горючее - смесь газов (формула 1.2.7).


Объём продуктов горения определяется по формуле (1.2.8)
 м3/м3
м3/м3
 м3/м3
м3/м3
Так как газовая смесь содержит в составе кислород, он будет окислять часть горючих компонентов, следовательно, понизится расход воздуха (формула 1.1.5).
В этом случае теоретический объём азота удобнее определять по формуле (1.2.14)
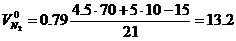 м3/м3
м3/м3
Теоретический объём продуктов горения
 м3/м3
м3/м3
Практический объём продуктов горения

Объём продуктов горения при температуре 1300 К
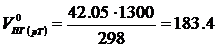 м3/м3.
м3/м3.
Пример 5. Определить состав продуктов горения метилэтилкетона.
Решение.
При такой постановки задачи рационально определить непосредственно из уравнения горения объём продуктов в кмолях, выделившихся при сгорании 1 кмоля горючего
 ,
,
 кмоля;
кмоля;  кмоля;
кмоля;  кмоля;
кмоля;  кмоля.
кмоля.
По формуле (1.2.11) находим состав продуктов горения


Пример 6. Определить объём и состав продуктов горения 1 кг минерального масла состава: С-85%, Н-15%, если температура горения 1450 К, коэффициент избытка воздуха – 1,9.
Решение. По формулам (1.2.3 - 1.2.6) определим объём продуктов горения
 м3/кг
м3/кг
 м3/кг
м3/кг
 м3/кг
м3/кг
Теоретический объём продуктов горения при нормальных условиях
 м3/кг
м3/кг
Практический объём продуктов горения при нормальных условиях формула (1.2.10)
 м3/кг
м3/кг
Объём продуктов горения при температуре 1450 К
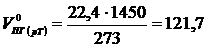 м3/кг
м3/кг
Очевидно, что состав продуктов горения не зависит от температуры горения, поэтому целесообразно определить его при нормальных условиях. По формулам (1.2.11;1.2.13)
 ;
;  ;
;


Пример 7. Определить количество сгоревшего ацетона, кг, если объём выделившийся двуокиси углерода, приведённый к нормальным условиям, составил 50 м3.
Решение.
Запишем уравнение реакции горения ацетона в воздухе

Из уравнения следует, что при горении из 58 кг (молекулярная масса ацетона) выделяется  м3 двуокиси углерода. Тогда для образования 50 м3 двуокиси углерода должно вступить в реакцию Мг горючего
м3 двуокиси углерода. Тогда для образования 50 м3 двуокиси углерода должно вступить в реакцию Мг горючего
 кг
кг
Пример 8. Определить количество сгоревшей органической массы состава C-58%, O-22%, H-8%, N-2%, W-10% в помещении объёмом 350 м3, если содержание двуокиси углерода составило 5%.
Решение. Определим объём выделившейся двуокиси углерода
 м3.
м3.
По формуле (1.2.6) для вещества сложного состава определим объём СО2, выделившейся при горении 1 кг горючего,
 м3/кг.
м3/кг.
Определим количество сгоревшего вещества
 кг.
кг.
Пример 9. Определить время, когда содержание двуокиси углерода в помещении объёмом 480 м3 в результате горения древесины (C-45%, H-50%, O-42%, W-8%) составило 8%, если удельная массовая скорость выгорания древесины 0,008 кг/(м2с), а поверхность горения 38 м2. При решении газообмен с окружающей средой не учитывать, разбавлением в результате выделения продуктов горения пренебречь.
Решение.
Поскольку не учитывается разбавление продуктов горения, определяем объём выделившейся в результате горения двуокиси углерода, соответствующей 8% её содержания в атмосфере
 м3
м3
Из выражения (1.2.3) определим, сколько должно сгореть горючего материала, чтобы выделился данный объём двуокиси углерода
 кг.
кг.
Время горения определим, исходя из соотношения

 ,
,
где  - время горения;
- время горения;
Мг - масса выгоревшей древесины, кг;
 - массовая скорость выгорания древесины, кг/(м2с);
- массовая скорость выгорания древесины, кг/(м2с);
F - поверхность горения, м2;
 мин.
мин.
Задание на самостоятельную работу
Задача 3: Определить объем продуктов горения при сгорании 1 кг заданного вещества, если тепература горения... К, давление... мм рт.ст., a=....
| Вариант | Вещество | Тп.г., К | Р, мм рт.ст. | a |
| Амилбензол | 1,1 | |||
| Н-Амиловый спирт | 1,2 | |||
| Анизол | 1,3 | |||
| Анилин | 1,4 | |||
| Бутилацетат | 1,5 | |||
| Бутиловый спирт | 1,6 | |||
| Бензол | 1,7 | |||
| Диэтиловый эфир | 1,8 | |||
| Ксилол | 1,1 | |||
| Уайт-спирит | 1,2 | |||
| Этиленгликоль | 1,3 | |||
| Трет-Амиловый спирт | 1,4 | |||
| Гексан | 1,5 | |||
| Метиловый спирт | 1,6 | |||
| Толуол | 1,7 | |||
| Стирол | 1,8 | |||
| Пентан | 1,1 | |||
| Этанол | 1,2 | |||
| Амилметилкетон | 1,3 | |||
| Бутилбензол | 1,4 | |||
| Бутилвиниловый эфир | 1,5 | |||
| Ацетон | 1,6 | |||
| Этиловый спирт | 1,7 | |||
| Гептан | 1,8 | |||
| Октан | 1,1 | |||
| Гексан | 1,2 | |||
| Бутиловый спирт | 1,3 | |||
| Анилин | 1,4 | |||
| Бензол | 1,5 | |||
| Ксилол | 1,6 |
Задача 4: Определить объем и состав (% об.) продуктов горения, выделившихся при сгорании 1 м3 горючего газа, если температура горения составила... К, давление... мм рт.ст.
| Вариант | Вещество | Тп.г., К | Р, мм рт.ст. | |
| Ацетилен | ||||
| Метан | ||||
| Окись углерода | ||||
| Этан | ||||
| Водород | ||||
| Пропан | ||||
| Сероводород | ||||
| Бутан | ||||
| Ацетилен | ||||
| Метан | ||||
| Окись углерода | ||||
| Этан | ||||
| Водород | ||||
| Пропан | ||||
| Сероводород | ||||
| Бутан | ||||
| Метан | ||||
| Этан | ||||
| Пропан | ||||
| Бутан | ||||
| Окись углерода | ||||
| Ацетилен | ||||
| Водород | ||||
| Метан | ||||
| Ацетилен | ||||
| Метан | ||||
| Окись углерода | ||||
| Этан | ||||
| Водород | ||||
| Пропан | ||||
Не нашли, что искали? Воспользуйтесь поиском: