
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Изобразите графически температурную зависимость мольной изобарной теплоемкости циклопентана в интервале от 0 до 100 °C, привлекая справочные данные.
РР-1
2. Найти возрастание энтропии при смешении 0,0001 м3 водорода при 303 К с 0,0002 м3 азота при 290 К (давление обоих газов 1 атм, их можно считать идеальными смешение происходит в сосуде с постоянным объемом).
3. Водно-метаноловый раствор с плотностью массы метанола 536,8 кг/ м3 имеет массу 2,10 кг и мольный объем 2,728 ×10 –5 м3/моль. Определить общее число молей и объем раствора, его мольную массу и удельное число молей, плотности общего числа молей и массы, удельный объем, числа молей и массы компонентов, их массовые и мольные доли, плотности чисел молей и плотность массы воды.
4. Определить графически парциальный мольный объем воды и рассчитать парциальный мольный объем сульфата лития в водном растворе с мольной долей его, равной 0,0075, по следующим данным:
 0,01 0,04 0,06 0,08 0,10
0,01 0,04 0,06 0,08 0,10
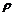 ,кг/м3 1007 1032 1051 1068 1086
,кг/м3 1007 1032 1051 1068 1086
РР-2
1. NО2 в газовой фазе разлагается в соответствии с уравнением 2NО2 = 2NО + О2. Если в сосуд объемом 0,1 м3 поместить 2 моля NО2 и нагреть сосуд до 775 К, то в нем в конце концов установится давление 1,63 атм. Рассчитайте состав возникшей газовой смеси в N- и с-шкалах.
2. Вычислить состав равновесной смеси, образующейся в результате протекания в газовой фазе при 1300 К и 0,5 атм следующей реакции
 (триметилбензол).
(триметилбензол).
Исходные вещества взяты в стехиометрических количествах,  =3,74, газы идеальные.
=3,74, газы идеальные.
3. Имеется смесь газообразных веществ А и В, которые могут вступать в химическую реакцию с образованием продукта реакции С, согласно стехиометрическому уравнению 3А + В = С. В начальный момент времени продукта реакции в системе нет, а исходные вещества взяты в стехиометрических количествах. После установления равновесия в равновесной смеси содержится число молей продукта С, равное 0,4, а общее давление равно 2 атм. Найдите константу равновесия в p-шкале.
РР-3
1. Определить нормальную температуру кипения этилового эфира, если давление его паров при 30 °C равно 0,846 ×10 5 Па, а мольная теплота испарения 28367,52 кДж/кмоль.
2. Для чистой воды известны температурные зависимости давления насыщенного пара при равновесии
| жидкость-пар | p, Па 871,2 3166,3 4023 6634 12335 Т, К 278,2 298,2 303 312,5 323,2 |
| Кристаллы-пар | p, Па 22,2 73,7 181 347 609,9 Т, К 238 250 259,7 266,7 273,2 |
В тройной точке плотности массы чистой воды в кристаллическом и жидком агрегатном состоянии равны соответственно 918 и 1000 кг/ м3. Определите графически координаты тройной точки и величины мольных теплот испарения и возгонки; определите мольную теплоту плавления, мольную энтропию плавления и мольную энергию Гиббса плавления; найдите температуру плавления вещества при давлении 90100 Па.
3. На основании приведенных данных о составах жидкой и паровой фаз при различных температурах постройте диаграмму фазового состояния системы бензол (1 компонент) – пропанол -2 (2 компонент)
| Т, К | 344,5 | |||||||
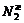
| 0,03 | 0,06 | 0,2 | 0,41 | 0,7 | 0,85 | ||

| 0,15 | 0,27 | 0,35 | 0,41 | 0,53 | 0,67 |
Обозначьте все поля, линии и характерные точки на этой диаграмме и укажите, сколько компонентов и фаз, находится в равновесии и чему равно число степеней свободы в каждой из указанных позиций. Ответьте, есть ли отклонения от закона Рауля и, если есть, то какие. Определите, какой компонент и в каком количестве нужно при 348 К добавить в систему (N2 = 0,1, масса системы 2 кг), чтобы перевести ее в пар
ДР
При температуре 951 К рассчитать значения стандартной мольной энтальпии, стандартной мольной энтропии, стандартной мольной энергии Гиббса реакции 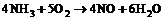 . Определить, возможно ли самопроизвольное протекание газовой реакции слева направо при этой температуре. В какую сторону будет смещаться равновесие данной реакции при изобарическом повышении температуры? Исходная смесь соответствует стехиометрическому составу, газы близки по свойствам к идеальным.
. Определить, возможно ли самопроизвольное протекание газовой реакции слева направо при этой температуре. В какую сторону будет смещаться равновесие данной реакции при изобарическом повышении температуры? Исходная смесь соответствует стехиометрическому составу, газы близки по свойствам к идеальным.
| <== предыдущая лекция | | | следующая лекция ==> |
| Характеристика конкретных заслуг | | | Мариупольский городской голова Иван Алексеевич Попов |
Не нашли, что искали? Воспользуйтесь поиском: