
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства никеля
(Пахомова Анна и Гусейнов Эльмин)
Никель (Ni) является элемент восьмой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28, относится к семейству железа. Простое вещество - это металл серебристо-белого цвета, пластичный, ковкий, при обычных температурах на воздухе образует тонкую оксидную пленку на поверхности. Ему присущи характерные свойства металлов. Химически малоактивен.
· Свойства атома:
1)Атомная масса (молярная масса): 58,6934 г/моль;
2)Строение внешнего электронного слоя: 3d84s2;
3)Радиус атома: 124пм.
· Электронная конфигурация:
1s22s22p63s23p64s23d8
На первом энергетическом уровне 2 электрона на s-орбитали, на втором-2 электрона на s-орбитали и 6 на p-орбитали, на третьем- 2 на s-орбитали, 6 на p-орбитали и 8 электронов на d-орбитали, на четвертом- 2 электрона на s-орбитали.[1]
· Химические свойства:
1)Ковалентный радиус: 115 пм;
2)Радиус иона: (+2е) 69пм;
3)Электроотрицательность: 1,91 (шкала Полинга);
4)Электродный потенциал: -0,25 В;
5)Степени окисления: 0; +1; +2; +3; +4(редкие и неустойчивые соединения);
6)Энергия ионизации: 736,2 кДж/моль.
В ряду активности металлов он находится между кобальтом и оловом:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
· Термодинамические свойства простого вещества:
1)Плотность (при н.у.): 8,902 г/см3;
2)Температура плавления: 1453 °С (1726 К, 2647 °F);
3)Температура кипения: 2732 °С (3005 К, 4949 °F);
4)Удельная теплота плавления: 17, 61 кДж/моль;
5)Удельная теплота испарения: 378,6 кДж/моль;
6)Молярная теплоёмкость: 26,1 Дж/моль;[2]
7)Молярный объём: 6,6 см3/моль.[3]
· Изотопы никеля:
Природный никель состоит из смеси пяти стабильных изотопов: 58Ni (67,76%), 60Ni (26,26%), 61Ni (1,25%), 63Ni (3,66%), 63Ni (1,16%).
“Изотопным составом объясняется меньший атомный вес природного никеля, по сравнению с кобальтом, имеющим порядковый номер 27.”[4] (Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина. - Москва: Издательство наука, 1966.- C.5-7.)
· Природные и искусственные полученные изотопы никеля:
1) 56Ni: тип излучения γ\ период полураспада 6, 4 дня\ происхождение изотопа искусственное\ содержание в природном никеле 0%;
2) 57Ni: тип излучения β+\ период полураспада 36 часов\ происхождение изотопа искусственное\ содержание в природном никеле 0%;
3) 58Ni: - \ стабилен\ происхождение изотопа естественное\ содержание в природном никеле 67,76%;
4) 59Ni: тип излучения К, нет β+\ 5∙104\ искусственное\ содержание в природном никеле 0%;
5) 60Ni: - \ стабилен\ происхождение изотопа естественное\ содержание в природном никеле 26,16%;
6) 61Ni: - \ стабилен\ происхождение изотопа естественное\ содержание в природном никеле 1,25%;
7) 62Ni: - \ стабилен\ происхождение изотопа естественное\ содержание в природном никеле 3,66%;
8) 63Ni: тип излучения β-\ период полураспада 125 лет\ происхождение изотопа искусственное\ содержание в природном никеле 0%;
9) 64Ni: тип излучения β-\ больше 3∙1015\ происхождение изотопа естественное\ содержание в природном никеле 1,16%;
10) 65N: тип излучения β-, γ\ период полураспада 2,6 часа\ происхождение изотопа искусственное\ содержание в природном никеле 0%;
11) 66Ni: тип излучения β-\ период полураспада 54,8 часа\ \происхождение изотопа искусственное\ содержание в природном никеле 0%.
В большинстве соединений никель положительно двухвалентен, но известны комплексные соединения, где никель имеет валентность +2 и +3. По химическим свойствам никель близок к железу и кобальту, отчасти, меди. Трудность окисления ионов Cu (2+) и Ni (2+) объясняется высокими значениями третьего потенциала ионизации (Энергии ионизации, т. е, энергии, необходимой для отрыва одного электрона от нейтрального атома. Отношение этой величины к заряду электрона есть ионизационный потенциал, т. е. напряжение электрического поля, достаточное для отрыва электрона.)
Как отмечалось ранее, никель нельзя отнести к активным металлам, он[5] обладает средней химической активностью, но тонкодисперсный порошок, полученный восстановлением соединений никеля водородом при низких температурах, пирофорен.[6]
“Никель является металлом сравнительно низкой химической активности. При обычных температурах, он покрывается тонкой защитной окисной пленкой и не взаимодействует с влагой воздуха, водой и рядом растворителей. Вода, насыщенная углекислотой, в присутствии ионов хлора может вызвать точечную коррозию никеля. Никель превосходно сопротивляется коррозии в щелочных растворах. Сильные щелочи — едкий натрий и едкий калий — на никель не действуют, так же как и безводный аммиак. Однако он растворяется в аммиачных растворах в присутствии (NH4)2CO3 с образованием растворимых аммиакатов, окрашенных в зеленый цвет ”. [7](Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство: Металлургия, 1985.-C.490.)
При обычных условиях никель устойчив к реакциям с кислородом, галoгенами, серой, щелочами. Сухие газы(окислы азота, сернистый газ и аммиак) при комнатной температуре с никелем не реагируют.
· Взаимодействие никеля с галогенами.
Металлический никель в отсутствии повышенной температуры и влаги устойчив к действию не только кислорода, но галогенов: фтор (F2), хлор (Cl2), бром (Br2), йод (I2), астат (At2). При обычных условиях никель с галогенами не реагирует.
 Ni + Hal →[8]
Ni + Hal →[8]
При нагревании никель реагирует со всеми галогенами с образованием дигалогенидов никеля.[9]
Ni + Hal2 →t NiHal2
1) Ni + F2 →t NiF2
2) Ni + Cl 2→t NiCl2
3) Ni + Br2 →t NiBr2
4) Ni + I2 →t NiI2
· Взаимодействие никеля с неметаллами.
Никель реагирует не со всеми неметаллами, так к действию фтора никель устойчив и не реагирует даже при температуре красного каления.
 Ni + F →
Ni + F →
С некоторыми неметаллами при создании специальных условий никель взаимодействует.
При обычных условиях никель устойчив.
 Ni + S →
Ni + S →
Однако, нагревание порошков никеля и серы приводит к образованию сульфида никеля (NiS).
Ni + S →NiS
Сульфиды никеля практически не растворимы в воде и органических растворителях. Разлагаются лишь азотной кислотой и царской водкой. При нагревании в вакууме выше 500°Сдиссоциируют с образованием паров серы и фаз, обогащенных никелем. При нагревании на воздухе окисляются.
· Взаимодействие никеля с кислородом.
При обычных условиях никель с кислородом не реагирует, и на воздухе он почти не изменяется.
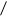 Ni + O2 →
Ni + O2 →
Но при высокой температуре (500 °C) реакция с кислородом протекает с образованием монооксида никеля (NiO), представляющий собой зеленовато-желтый светлый порошок. Происходит окислительно-восстановительная реакция, и никель переходит из Ni 0 в Ni +4.
2Ni + O2 →t 2NiO
Однако, в мелкодисперсном состоянии (в виде мелкораздробленного порошка) никель обладает пирофорностью, т. е. самовоспламеняется на воздухе даже при обычной температуре.
Как отмечалось ранее, в мелкодисперсном состоянии никель пирофорен, и способен поглощать большое количество газов (Н2, СО и др.), что, кстати,[10] ухудшает его свойства. Так при реакции с монооксидо углерода (II) образуется карбид никеля, представляющий собой серые кристаллы.
3Ni+ 2CO →t Ni3C + CO2
При неизмельченном состоянии металла возможно образование тетракарбонила никеля, представляющего собой бесцветную жидкость.
Ni +4 CO→tNi(CO)4[11]
При реакции с водородом образуется гидрид никеля, представляющий собой черные кристаллы.
Ni + H2 →t NiH2
“В тонко раздробленном состоянии никель адсорбирует водород, на этом свойстве никеля основано применение никеля и его соединений в качестве катализатора, ускоряющего присоединение или отщепление водорода.” (Никель//Большая советская энциклопедия/.-1939.-Т42.-С.111.)
· Взаимодействие никеля с водой.
По отношению к воде никель устойчив. Его гидроксо-соединения, такие как гидроксид никеля (II) Ni(OH)2 и гидроксид никеля (III) Ni(OH)3 получают косвенным путем.
· Взаимодействие никеля с щелочами.
Щелечи как в водных растворах так и расплавах не действуют на никель.
 Ni + NaOH →
Ni + NaOH →
· Взаимодействие никеля с кислотами.
При реакции с кислотами такими как азотная, серная, соляная, образует соответствующие двухвалентные соли.[12]
Никель легко растворяется в разбавленных кислотах, при этом он образует аквакатиона [Ni(H2O)6] с зарядом 2+. Стоит заметить, что с соляной, серной, фосфорной, фтористоводородной кислотами никель реагирует медленно.
Ni +2HCl (разб.) →tNiCl2 + H2↑[13]
Ni +H2SO4 (разб.)→ Н2↑+ NiSO4
Легче и быстрее всего никель реагирует с разбавленной азотной кислотой.
Ni + 8HNO3 (разб.)→ Ni(NO3)2 + 2NO↑ +4H2O
При действии на никель концентрированных серной и азотной кислот, они лишь пассивируют металл, т е приводят к образованию на поверхности оксидных пленок, как и в случае c железом.
“Органические кислоты действуют на Никель, лишь после длительного соприкосновения с ними”. (Грибовская И. Ф. Никель/И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.611.)
· Взаимодействие никеля с солями.
В силу малой химической активности никеля такие соединения как сода (Na2CO3), поташ (K2CO3) не взаимодействуют с металлом.
 Ni + Na2CO3→
Ni + Na2CO3→
 Ni + K2CO3→
Ni + K2CO3→
Однако, такие малоактивные металлы как медь (Cu) никель вытесняет из солей
Ni + CuSO4 → NiSO4 + Cu
“Никель один из самых активных металлов — катализаторов. Ката-
литическая активность никеля зависит от степени дисперсности порошка,
его чистоты и методики его получения. Каталитическими свойствами об-
ладают многие сплавы никеля с алюминием, молибденом и с другими
элементами, а также и некоторые соединения: оксид, сульфид, бориды
никеля и другие.”[14]
10. Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
Федоров П. И. Никель/ П. И. Федоров// Химическая энциклопедия.-1992.-Т.3.-С.240-242.
Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.481-492.
[2] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
[3] Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.481-492.
[4] Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина.-Москва: Издательство наука, 1966.-C.5-7.
[5] Пешкова В. М. Аналитическая химия никеля / В. М. Пешкова, В. М. Савостина/.-Москва: Издательство наука, 1966.-C.5-7.
[6] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.110-111.
Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
[7] Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство: Металлургия, 1985.-C.490.
[8] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Интегралл-Пресс, 2002.-С.529.
[9] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Химия, 1985.-С.673-675.
[10] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
[11] Никель //Большая советская энциклопедия/.-1939.-Т42.-С.111.
[12] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.611.
Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Интегралл-Пресс, 2002.-С.529.
[13] Глинка Н. Л. Общая химия/ Н. Л. Глинка.-Москва: Издательство Химия, 1985.-С.673-675.
Диогенов Г. Г. Никель: прошлое, настоящее, будущее/ Г. Г. Диогенов// Химия в школе.-2001.-№8.-С.90-92
[14] Грибовская И. Ф. Никель/ И. Ф. Грибовская//Большая советская энциклопедия/.-1974.-Т17.-С.610-613.
Дриц М. Е. Свойства элементов / М. Е. Дриц [и др.].- Москва: Издательство Металлургия, 1985.-С.490.
| <== предыдущая лекция | | | следующая лекция ==> |
| Работникам столовой | | | Характеристика железнодорожных колёс. Потребитель железнодорожных колёс и области их применения. |
Не нашли, что искали? Воспользуйтесь поиском: