
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ДИСОЦІАЦІЯ ВОДИ . ГІДРОЛІЗ СОЛЕЙ
Мета вивчення теми:
- обчислювати pH і pOH, концентрацію іонів Н+ і OН - у водних розчинах;
- складати іонні і молекулярні рівняння реакцій гідролізу солей.
Для води як слабкого електроліту константу рівноваги дисоціації можна записати так:
H2О «Н+ + ОН-
к д = [ Н+]×[ОН -] /[Н2O],
звідки вважаючи на практично сталу концентрацію води
К Н2О = [Н+] [ОН -] = к д × [Н2O] = К Н2О
Величина К Н2O називається іонним добутком води. При 250С К Н2O = 10-14. Значить, у воді і водних розчинах концентрації іонів [ Н+] та [ОН -] пов’язані одна з одною:
[ Н+] =  , а [ОН -] =
, а [ОН -] =  .
.
Замість концентрацій іонів Н+ і ОН- зручніше користуватися їхніми десятковими логарифмами, взятими зі зворотним знаком; ці величини позначаються символами pH і pOH і називаються відповідно:
pH = -lg [ Н+] - водневий показник;
pOH = -lg [OН-] - гідроксильний показник;
pH + pOH = 14.
Водневий і гідроксильний показники можуть служити мірою кислотності або лужності водних розчинів:
в кислих розчинах pH < 7, а pOH > 7;
в нейтральних - pH = pOH = 7;
в лужних - pH > 7, pOH < 7.
Приклад 1. Обчислити pН розчину, у 2 л якого знаходиться 0,8 г NaOH. Дисоціацію лугу вважати повною.
Розв’язання. Луг дисоціює цілком (a = 1), і з однієї молекули NaOH утворюється один іон OH- (n = 1):
NaOH ®Na+ + ОН-
Обчислимо молярну концентрацію іонів ОН- у цьому розчині:
[OН-] = m (NaOH) /(М (NaOH) × V) = 0,8 /(40×2) = 10-2 моль/л.
Обчислимо pOH розчину: pOH = -lg [OН-] = -lg 10-2 = 2.
Враховуючи, що pH + pOH = 14, знаходимо pH:
pH = 14 – pOH = 14 – 2 = 12.
Реакцію розчину (кислий або лужний характер середовища) на практиці можна визначити за допомогою індикаторів – слабких органічних кислот або основ, що мають різне забарвлення в дисоційованій і молекулярній формах. Забарвлення деяких з них у різних середовищах приведені у таблиці.
Реакції нейтралізації, у яких беруть участь слабкі кислоти або основи, оборотні, тобто можуть протікати не тільки в прямому, але і в зворотному напрямку. Тому гідроліз солі є оборотним процесом стосовно реакції нейтралізації:
| нейтралізація | ||
| Кислота + основа | « | сіль + вода. |
гідроліз
Отже, при розчиненні у воді солі, до складу якої входить аніон слабкої кислоти або катіон слабкої основи, протікає процес гідролізу – обмінної взаємодії солі з водою, у результаті якого утворюється слабка кислота або слабка
основа. Оскільки нейтралізація супроводжується виділенням теплоти, то гідроліз є ендотермічним процесом (∆ H > 0). Крім того, гідроліз – оборотний процес.
Таблиця
| Індикатор | Забарвлення в середовищі | Інтервал переходу РН | ||
| кисле | нейтральне | Лужне | ||
| Лакмус | червоне | фіолетове | Синє | 5,0-8,0 |
| Фенолфталеїн | безбарв. | безбарвний | Малинове | 8,2-10,0 |
| Метилоранж | рожеве | оранжове | Жовте | 3,1-4,4 |
При складанні іонних рівнянь гідролізу солей виходьте з того, що з водою взаємодіють ті катіони або аніони, що з іонами води (Н+ або ОН-) можуть утворити слабкі електроліти. Наприклад, якщо розчинити у воді хлорид міді CuCl2 або сульфід натрію Na2S, то в першому випадку з водою будуть взаємодіяти іони Cu2+, а в другому – іони S2- по таких схемах:
а) I стадія:
Cu2+ + Н2О «(CuОН)+ + Н+ ; CuCl2+ Н2О «Cu(ОН)Сl + НСl
П стадія:
(CuОН)+ +Н2О«Cu(ОН)2+Н+; Cu(ОН)Сl+Н2О«Cu(ОН)2+НСl
б) I стадія:
S2- +Н2О«НS- +ОН- ; Na2S +Н2О «NaНS +NaОН
П стадія:
НS-+Н2О «Н2S + ОН-; NaНS +Н2О «Н2S +NaОН.
Отже, у реакції гідролізу можуть фактично брати участь або катіон основного залишку, якщо сіль утворена слабкою основою і сильною кислотою (як CuCl2), або аніон кислотного залишку, якщо сіль утворена слабкою кислотою і сильною основою (як Na2S), або одночасно і катіон, і аніон, якщо сіль утворена слабкою основою і слабкою кислотою (як CH3COONН4):
CH3COONН4 ® NН4+ + CH3COO-
NН4++ CH3COO- + Н2О «NН4ОН + CH3COOН
CH3COONН4 + Н2О «NН4ОН + CH3COOН.
Запам'ятайте, що якщо катіон або аніон, що беруть участь у гідролізі, багатозарядні, то гідроліз протікає по стадіях, при чому число стадій дорівнює абсолютній величині заряду відповідного іона. Тому гідроліз СuCl2 і Na2S протікає в дві стадії, а гідроліз Al(NO3)3 - в три, оскільки катіон алюмінію має заряд +3. Переважно гідроліз перебігає по першій стадії.
Деякі солі (найчастіше утворені слабкою нерозчинною основою і дуже слабкою летючою кислотою) піддаються повному гідролізу. Такі солі не можуть існувати у водних розчинах, тому що цілком розкладаються водою на відповідні основу і кислоту, як, наприклад, сульфід або карбонат алюмінію (Al2S3, Al2(CO3)3 та ін.). У таблицях розчинності проти таких солей стоїть прочерк "-". Про це не можна забувати при складанні рівнянь реакцій обміну між розчинами електролітів.
Приклад 2. Скласти рівняння реакцій, що протікають при зливанні водних розчинів хлориду хрому (Ш) і сульфіду натрію.
Розв’язання. Спочатку запишемо рівняння реакції, знаючи, що при обмінній взаємодії двох солей повинні утворитися дві нові солі:
2CrCl3 + 3Na2S = Cr2S3 + 6NaCl.
Користуючись таблицею розчинності солей, перевіряємо, чи існують продукти реакції у водному розчині. Хлорид натрію існує, а проти сульфіду хрому(Ш) стоїть прочерк, тобто ця сіль піддається повному гідролізу. Тому не можна обмежитися вищенаведеним рівнянням реакції, а треба написати ще одне - повний гідроліз сульфіду хрому(Ш) - і скласти обидва рівняння. Тоді маємо для сумарного процесу:
Cr2S3 + 6 H2O = 2Cr(OH)3¯ + 3H2S.
Сумарне рівняння повного гідролізу:
2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3¯ + 3H2S+ 6NaCl,
і в іонно-молекулярному вигляді:
2Cr3+ + 3S2- + 6H2O = 2Cr(OH)3¯ + 3H2S.
У результаті протікання гідролізу зміщується рівновага дисоціації води, і у розчині солі з'являється деякий надлишок іонів H+ або OH-. Це приводить до зміни кислотності або лужності середовища. Варто пам'ятати, що характер середовища розчину солі визначається більш сильним з утворюючих її компонентів. Так, розчин солі Na2CO3 має лужне середовище (рН >7), тому що ця сіль утворена сильною основою NaOH і слабкою кислотою H2CO3, а розчин солі ZnCl2 – кисле (рН <7), тому що вона утворена сильною кислотою HCl і слабкою основою Zn(OH)2. Якщо ж сіль утворена слабкою кислотою і слабкою основою, то середовище розчину такої солі може бути або слабокислим, або слаболужним. Останнє залежить від співвідношення констант дисоціації утворюючих сіль слабкої основи і слабкої кислоти.
Приклад 3. Визначити реакцію середовища розчину ціаніду амонію.
Розв’язання. Ціанід амонію в розчині дисоціює на іони:
NH4CN ® NH4+ + CN-.
Оскільки ця сіль утворена слабкою основою NH4OH і слабкою кислотою HCN, то в реакції гідролізу беруть участь і катіон, і аніон:
NH4+ + CN- + H2O «NH4OH + HCN
або в молекулярній формі:
NH4CN + H2O «NH4OH + HCN.
У результаті реакції утворяться слабка основа і слабка кислота, але так як K Д( ) = 1,8 ·10-5 > К Д(HCN) = 8·10-10,
) = 1,8 ·10-5 > К Д(HCN) = 8·10-10,
то середовище розчину буде слабколужним.
Оскільки гідроліз – процес оборотний, то зміщуючи його рівновагу (додаванням до розчину солі різних речовин – кислот, основ, води) можна гідроліз зменшити або підсилити. Так, наприклад, гідроліз солі ZnCl2 зменшується при додаванні до розчину кислоти:

Zn2+ + H2O «Zn OH+ + H+
НСl ® H+ + Сl-
Підсилити гідроліз можна також шляхом розведення солі або нагріванням.
Кількісними характеристиками процесу є ступінь (aг) і константа (К г) гідролізу. Перша показує частку розчинених молекул солі, що піддалися гідролізу і виражається в % або в частках одиниці:
aг = N г / N заг
де N г – число молекул солі, що піддалися гідролізу, а N заг – загальна кількість молекул солі.
Друга величина (К г) фактично є константою рівноваги реакції гідролізу. Взаємозв'язок між aг і Кг виражається так: 
aг = 
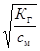

де с м – молярна концентрація розчину солі, моль/л.
ДОМАШНЄ ЗАВДАННЯ
1. Кислі шахтні води вугільних родовищ мають рН = 5. У
скільки разів концентрація іонів ОН- менша концентрації іонів Н+ у цьому розчині? Відповідь: у 104 разів.
2. Обчисліть рН і рОН у 0,01М розчині гідроксиду барію
Ва(ОН)2, якщо ступінь дисоціації Ва(ОН)2 дорівнює 90%.
Відповідь:рН =12,26; рОН=1,74.
3. Кислі стічні води після травлення виробів зі сталі послідовно нейтралізують вапняним молоком до рН=8. Обчисліть концентрацію іонів Н+ і ОН- в отриманих розчинах. Чому дорівнює рОН у цьому розчині?
Відповідь: [H+] = 10-8 моль/л; [ОH-] =10-6 моль/л; рОН=6.
4. У 5 л шахтної води однієї із шахт Донбасу утримується 0,05 молей азотної кислоти. Вважаючи дисоціацію кислоти повною, обчисліть концентрацію іонів ОH- у цій воді.
Відповідь:10-12 моль/л.
5. Обчисліть рН 0,001н розчину КОН, якщо a = 100%. Яке забарвлення набуде лакмус у цьому розчині?
Відповідь: рН =11.
6. Які солі із наведених нижче будуть піддаватися гідролізу при розчиненні у воді: NaCl, K2CO3, Al(NO3)3, ZnCl2, (NH4)2S? Складіть рівняння реакцій гідролізу цих солей в іонному та іонно-молекулярному вигляді і вкажіть значення рН у розчинах даних солей (більше або менше 7).
7. Які солі із приведених нижче будуть піддаватися повному гідролізу при розчиненні у воді: NaCl, Na2CO3, Al2(CO3)3, SnSO3, FeCl3? Складіть рівняння реакцій гідролізу цих солей в іонному і іонно-молекулярному вигляді.
8. При зливанні водних розчинів карбонату натрію і сульфату алюмінію випадає білий осад і виділяється газ. Яка речовина випадає в осад? Який газ виділяється? Складіть рівняння реакцій, що протікають у розчині, у молекулярному та іонно-молекулярному вигляді.
9. В окремих пробірках знаходяться розчини солей: NaCl, Al2(SO4)3, Na2CO3. Як за допомогою індикатора встановити, в якій пробірці знаходиться яка сіль? Відповідь мотивуйте, склавши рівняння гідролізу солей.
10. Враховуючи можливість повного гідролізу солей у воді, напишіть рівняння реакцій обміну між водними розчинами хлориду хрому(Ш) і карбонату натрію в молекулярному й іонно-молекулярному вигляді. Яка речовина випадає в осад? Який газ виділяється при нагріванні розчину?
Не нашли, что искали? Воспользуйтесь поиском: