
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристики наиболее распространенных токсичных веществ и защита от них
Тяжелые металлы
Среди химических веществ, загрязняющих окружающую среду (воздух, воду, почву) тяжелые металлы и их соединения образуют значительную группу веществ, оказывающих существенное неблагоприятное воздействие на человека. Высокая токсичность и опасность тяжелых металлов для здоровья человека, возможность их рассеяния в окружающей среде диктует необходимость контроля и разработки мер защиты от них.
Источники загрязнения биосферы тяжелыми металлами:
-предприятия черной и цветной металлургии (аэрозольные выбросы, загрязняющие атмосферу, промышленные стоки, загрязняющие поверхностные воды);
- машиностроения (гальванические ванны меднения, никелирования, хромирования, кадмирования);
-заводы по переработке аккумуляторных батарей, -автомобильный транспорт.
Опасность тяжелых металлов обусловлена их устойчивостью в окружающей среде, растворимостью в воде, сорбцией (поглощением) почвой, растениями, что в совокупности приводит к накоплению тяжелых металлов в среде обитания человека.
Согласно прогнозам, тяжелые металлы могут стать более опасными загрязнителями, чем отходы АЭС.
К тяжелым металлам относят более 40 химических элементов периодической системы Д.И. Менделеева с атомными массами более 50 а.е.м. Число наиболее опасных тяжелых металлов, если учитывать их токсичность, стойкость, способность накапливаться в окружающей среде, а так же масштабы распространения значительно меньше указанного
(Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg.)
В организм человека они попадают с продуктами питания и водой, а также через органы дыхания. В организме человека тяжелые металлы образуют сложные соединения, которые вызывают поражение живой ткани, что приводит к нарушениям работы отдельных систем или организма в целом.
О вредности тяжелых металлов можно судить по ПДК, значения которых для наиболее опасных элементов приведено в таблице
| Наименование | Условное обозначение | Среднесуточная ПДК, мг/м3 | № группы опасности |
| Свинец | Pb | 0,0003 | |
| Ртуть | Hg | 0,0003 | |
| Никель | Ni | 0,0002 | |
| Селен | Se | 0,00005 | |
| Мышьяк | As | 0,0003 | |
| Кадмий | Cd | 0,001 | |
| Медь | Cu | 0,002 | |
| Марганец | Mn | 0,001 | |
| Цинк | Zn | 0,05 | |
| Олово | Sn | 0,05 |
В то же время некоторые тяжелые металлы крайне необходимы организму.
Железо входит в состав гемоглобина крови и многих окислительных ферментов. Его недостаток в организме может вызвать такое заболевание, как анемия (малокровие). Суточная норма поступления железа в организм – 15 мг. Из продуктов много железа содержится в печени (особенно в свиной), зелени петрушки, яичном желтке, фруктах и овощах.
Медь входит в состав окислительных ферментов. Функции меди тесно связаны с функциями железа. Медь необходима, она влияет на процесс роста. Суточное поступление меди в организм – 2-5 мг. Наиболее богаты медью говяжья печень, печень палтуса и трески.
Кроме того, организм постоянно нуждается в ничтожно малых следовых количествах кобальта, стронция, марганца, цинка, цезия и других металлов. Но роль их в обмене веществ очень велика.
В качестве примера рассмотрим наиболее распространенные из тяжелых металлов, такие как свинец и ртуть.
Свинец Pb
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д
В организм человека проникает главным образом через органы дыхания и пищеварения. Удаляется из организма очень медленно, вследствие чего накапливается в костях, печени и почках.
Отравление свинцом называется “ сатурнизм ”. Свинец и его соединения являются политропными ядами (т.е. действуют на разные органы и системы организма) и вызывают в основном изменения в нервной и сердечно-сосудистой системах, а также нарушения ферментативных реакций, витаминного обмена, снижают иммунобиологическую активность человека.
Высокая степень риска свинцового отравления отмечается у детей младшего возраста. Это объясняется тем, что детский организм сорбирует до 40 % поглощенного с пищей свинца, в то время как организм взрослого человека — всего от 5 до 10 %. Все соединения свинца очень ядовиты, особенно его органические производные. Соединения свинца откладываются в костях, а также в мышцах и печени. Действие свинца связано с глубоким нарушением обменных процессов, в первую очередь белкового обмена, минерального (кальция и фосфора) обмена и витаминного обмена. Наиболее частыми формами отравления свинцом являются малокровие, свинцовые колики, плеврит, гепатит. Уже при небольших дозах наступают нарушение кроветворных функций костного мозга и разрушение эритроцитов, что ведет к малокровию.
Ртуть – жидкий металл серебристо-белого цвета. Плотность – 13,52 г/см3, ТПЛ=-39°C, ТИСП=22-23°C, ТК=357°C. Он находит широкое применение при изготовлении термометров, светильников, ламп дневного света, измерительных приборов (манометров, барометров), в приготовлении препаратов для защиты дерева от гниения.
В организм человека ртуть попадает через органы дыхания, кожу, желудочно-кишечный тракт. Признаки отравления проявляются через 8-24 часа и выражаются в общей слабости, усилении головной боли, повышении температуры. Через некоторое время появляются боли в животе, наблюдается расстройство желудка, боли в деснах.
Пары ртути проникают в пористые материалы и там оседают, ртуть переходит в жидкое состояние. При повышении температуры ртуть вновь испаряется и этот процесс может повторяться многократно. При этом ПДК может превышаться в десятки тысяч раз.
Например, если в комнате площадью S=12 м2 (объем комнаты составит V = 30 м3) разбить градусник, в котором содержится 0,6 г ртути, и не удалить ртуть, то при температуры выше 23° С произойдет ее испарение и концентрация ртути превысит ПДК в
 тыс. раз.
тыс. раз.
Средства защиты от ртути:
для органов дыхания:
- при незначительных концентрациях, необходимо пользоваться промышленным противогазом, оснащенным противогазовой коробкой черного цвета, имеющей маркировку буквы «Г» или респиратором РПГ-60Г;
- при повышенной концентрации, более 1мг/м3, необходимо пользоваться только изолирующим противогазом;
для кожи: специальная одежда.
Первая помощь при отравлении ртутью:
- при попадании ртути в желудочно-кишечный тракт необходимо промыть желудок водой с добавлением 20 – 30 г. активированного угля или водой с яичным белком, после чего дать молоко, а затем слабительное;
- при отравлении через органы дыхания больному необходим покой и немедленная медицинская помощь.
Основные методы удаления пролитой ртути (демеркуризация):
- механический: используя пластинку станиоля (бумагу) ртуть тщательно собрать и удалить в безопасное место;
- химический: приготовить раствор из 10 л воды, 20 мг марганцовокислого калия, 50 мг соляной кислоты и обильно смочить место разлива ртути; после высыхания это место промыть мыльной водой; вместо марганцовокислого калия для удаления ртути может быть использовано хлорное железо.
Тяжелые металлы в организм человека очень часто попадают с продуктами питания при использовании эмалированной посуды. Если эмаль имеет матовый цвет или сколы, то в пищу могут попадать кадмий, сурьма, цинк, кобальт, хром, свинец, медь, мышьяк и др. Такая посуда практическому использованию не подлежит.
Токсичные вещества нервно-паралитического действия
К группе токсичных веществ нервно-паралитического действия относятся фосфорорганические соединения (V-газы, зарин, зоман), сероуглерод, тетраэтилсвинец, сакситоксин, тетродотоксин, а также яды растительного происхождения: стрихнин, кураре, конин.
Токсичные вещества нервно-паралитического действия подавляют активность фермента холинэстеразы, что создает условия для накопления ацетилхолина, который препятствует прохождению возбуждения (сигнала) от нервной клетки к мышце.
Первые признаки поражения: сужение зрачков (миоз), затруднение дыхания.
Защита.
Фильтрующие противогазы в исправном состоянии и с хорошо подогнанной лицевой частью типа ГП-7 полностью защищают органы дыхания, лицо и глаза от токсичных веществ нервно-паралитического действия
Первая помощь.
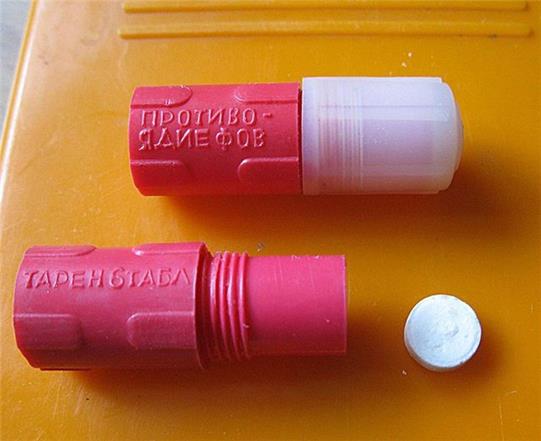 При угрозе поражения токсичными веществами нервно-паралитического действия в целях профилактики принимаются таблетка антидота из аптечки АИ-1.
При угрозе поражения токсичными веществами нервно-паралитического действия в целях профилактики принимаются таблетка антидота из аптечки АИ-1.
При поражении токсичным веществом нервно-паралитического действия необходимо как можно быстрее принять еще одну таблетку антидота или ввести внутримышечно атропин, который находится в аптечке АИ-1 или в санитарной сумке в шприц-тюбике.
Токсичные вещества удушающего действия
В эту группу входят токсичные вещества, при вдыхании которых поражается легочная ткань. В первую очередь разрушаются стенки альвеол и капилляров. Легкие заполняются жидкостью. Возникает токсический отек легких, которые могут увеличиться в массе на 500-600 г. В организме нарушается нормальный газообмен. Кровь обедняется кислородом при одновременном увеличении в ней двуокиси углерода. В организме развивается кислородное голодание – гипоксемия, переходящая в гипоксию, нарушаются окислительно-восстановительные процессы в тканях. Первыми погибают клетки нервной системы, что сразу же нарушает управление сердечной мышцей, работа сердца прекращается. При этом само сердце никаких повреждений не получает.
Наиболее распространенными представителями этой группы веществ являются: хлор, фосген, сернистый ангидрид, фторсодержащие соединения и др.
Хлор (Cl2) – газ зеленовато-желтого цвета с резким раздражающим запахом, в 2,5 раза тяжелее воздуха, ТК=-34,6°C, взрывоопасен, поддерживает горение многих органических веществ.
Применяется в различных отраслях промышленности: бумажно-целлюлозной, текстильной, при хлорировании воды. Перевозится и хранится в сжиженном состоянии.
Хлор раздражает дыхательные пути и вызывает отек легких. Характерный признак поражения – посинение кожи лица.
Смертельная концентрация при минутной экспозиции – 6 мг/л.
При более высокой концентрации смерть может наступить от 1-2 вдохов, вследствие рефлекторного торможения дыхательного центра.
Среднесуточная ПДК составляет 0,03 мг/м3.
Защита от поражающего действия:
- необходимо во всех случаях избегать низких мест, потому что они могут быть заполнены хлором;
- при незначительных концентрациях можно использовать влажную ватно-марлевую повязку, так как
Cl2+H2O→HCl+О2;
- при концентрациях до 8,6 мг/л необходимо использовать фильтрующий противогаз ГП-7 или промышленный противогаз с коробкой желтого цвета имеющей маркировку буквы «В»;
- при высоких концентрациях более 8,6 мг/л используется только изолирующий противогаз.
Первая помощь при поражении хлором: надеть на пораженного противогаз, вынести из зоны заражения, обеспечить доступ кислорода и полный покой, при необходимости до прибытия врача применить ингаляцию кислородом; искусственное дыхание противопоказано.
Фосген (COCl2) – бесцветный газ с запахом прелого сена, тяжелее воздуха в 3,4 раза, ТК=8,2°С.
Применяется в химической и текстильной промышленности. Перевозится и хранится в сжиженном состоянии. Фосген выделяется при сжигании пластмасс и искусственных волокон, в том числе обуви на полиуретановой подошве.
Фосген является типичным токсичным веществом удушающего действия поражающим легочную ткань. Кроме того, он оказывает раздражающее действие на глаза и слизистые оболочки. Период скрытого действия 4-5 часов.
Признаки отравления: дыхание становится поверхностным, появляется кашель с выделением пенистой мокроты с кровью, пульс учащается, появляется головная боль, головокружение, боль в груди и горле, происходит посинение кожи лица, ушей, кистей рук. При тяжелых отравлениях смерть наступает от отека легких.
Смертельная концентрация при минутной экспозиции – 5 мг/л. При концентрации более 40 мг/л смерть наступает практически мгновенно.
Защита от фосгена и первая помощь при поражении такие же, как при поражении хлором.
Токсичные вещества
общеядовитого действия
Токсичные вещества общеядовитого действия вызывают общее отравление организма. Одни из них приводят к нарушению внутриклеточного и тканевого дыхания, это происходит вследствие подавления в тканях железосодержащих ферментов, которые отбирают из крови кислород для окислительных процессов в клетках. В этом случае в организме развивается кислородное голодание – гипоксия.
Наиболее распространенными представителями этой группы являются цианиды – синильная кислота (HCN) и хлорциан (ClCN).
Другие действуют на гемоглобин крови, приводя к распаду эритроцитов, что нарушает транспортные функции гемоглобина по доставке кислорода к тканям организма, т.е. развивается гипоксемия, переходящая в гипоксию.
Представителями данной группы являются: мышьяковистый водород (AsH3), фосфористый водород (РН3), окись углерода (CO), карбонилы металлов, – это соединения марганца, никеля, железа, вольфрама, кобальта, калия, натрия и др. с окисью углерода.
Синильная кислота (HCN ) – бесцветная жидкость с запахом горького миндаля, ТК=25,7°C, ТЗ=-13,4°C, плотность пара по воздуху 0,947, легко проникает в пористые строительные материалы, например изделия из дерева, проникает через неповрежденную яичную скорлупу, адсорбируется многими пищевыми продуктами. Перевозится и хранится в жидком состоянии. Смесь паров синильной кислоты с воздухом (6:400) может взрываться, по своей силе взрыв превосходит взрыв тротила.
В промышленности синильная кислота применяется для производства органического стекла, каучуков, пестицидов (гербицидов). Несмотря на запрет, широко применяется для уничтожения насекомых и грызунов в зернохранилищах, складах и на кораблях.
В организм человека синильная кислота попадает через органы дыхания, с водой, продуктами питания и через кожу.
Механизм действия синильной кислоты на организм человека состоит в нарушении внутриклеточного и тканевого дыхания вследствие подавления активности железосодержащих ферментов ткани. Молекулярный кислород из легких к тканям поставляется гемоглобином крови в виде комплексного соединения содержащего ион железа Hb(Fe2+)О2. В тканях кислород преобразуется в группу (ОН), а затем взаимодействует с ферментом цитохромоксидазы, который представляет собой сложный белок, содержащий ион железа Fe2+. Ион Fe2+ отдает кислороду электрон, переходит в ион Fe3+ и связывается с группой (ОН).
Так происходит передача кислорода из крови в ткани организма. В дальнейшем кислород участвует в окислительных процессах ткани, а ион Fe3+, приняв электрон от других цитохромов, преобразуется в ион Fe2+, который вновь готов взаимодействовать с гемоглобином крови.
Если же в ткани попадает синильная кислота, она сразу же взаимодействует с железосодержащей ферментной группой цитохромоксидазы, в момент образования иона Fe3+ к нему вместо гидроксильной группы (ОН) присоединяется цианистая группа (CN). В дальнейшем железосодержащая группа фермента в отборе кислорода из крови не участвует.
Так нарушается клеточное дыхание при попадании синильной кислоты в организм человека. При этом не нарушено ни поступление кислорода в кровь, ни перенос его гемоглобином к тканям.
Артериальная кровь насыщается кислородом, переходит в вены, что выражается в ярко-розовой окраске кожных покровов. Ярко-розовая окраска кожных покровов является характерным признаком поражения синильной кислотой.
Наибольшую опасность для организма представляет вдыхание паров синильной кислоты, так как они кровью разносятся по всему организму, вызывая подавление окислительных реакций во всех тканях. При этом гемоглобин крови не поражается, так как ион Fе2+ гемоглобина крови не взаимодействует с цианистой группой.
Отравление легкой степени возможно при концентрации синильной кислоты 0,04-0,05 мг/л и времени действия более 1 часа. Признаками отравления являются ощущение запаха горького миндаля, металлический привкус во рту, царапание в горле.
Отравление средней степени возникает при концентрации 0,12-0,15 мг/л и экспозиции 30-60 минут. К выше названным симптомам добавляются ярко-розовая окраска слизистых оболочек и кожи лица, тошнота, рвота, нарастает общая слабость, появляется головокружение, нарушается координация движений, наблюдается замедление сердцебиений, расширение зрачков глаз.
Тяжелое отравление возникает при концентрации 0,25-0,4 мг/л и экспозиции 5-10 минут. Оно сопровождаются судорогами полной потерей сознания, сердечной аритмией. Затем развивается паралич и полностью останавливается дыхание.
Смертельной концентрацией синильной кислоты принято считать 1,5-2 мг/л при экспозиции 1 мин или 70 мг на человека при попадании организм с водой или пищей. ПДК – 0,01 мг/м.3
Защита. Фильтрующий противогаз надежно защищает от синильной кислоты. При нахождении в атмосфере, зараженной синильной кислотой, необходимо пользоваться защитной одеждой.
Первая помощь при поражении синильной кислотой:
- на пораженного надеть противогаз, вынести из зоны заражения, обеспечить доступ кислорода;
- для лечения следует применять антидот амилнитрит или пропилнитрит (раздавленную ампулу с антидотом быстро вводят под лицевую часть противогаза еще в зоне заражения), при необходимости делают искусственное дыхание или применяют кислородную терапию;
- синильную кислоту, попавшую на кожу, смывают 2% раствором соды или водой с мылом.
Окись углерода (СО) – бесцветный газ, не имеющий вкуса и  запаха, плотность по воздуху 0,967, плохо растворяется в воде, ТК=-191,5°С,
запаха, плотность по воздуху 0,967, плохо растворяется в воде, ТК=-191,5°С,
ТЗ=-205°С, плохо сорбируется пористыми материалами, в том числе и активированным углем, легко проникает через слой земли и кирпичные стены.
Окись углерода называют кровяным ядом, она вызывает общее отравление организма при действии исключительно через органы дыхания. Из легких окись углерода поступает в кровь, где соединяется с ионом железа Fe2+, входящим в состав гемоглобина, при этом связывается с ним в 250 – 300 раз прочнее, чем кислород. Так гемоглобин исключается из процесса переноса кислорода из легких к тканям. В организме возникает кислородное голодание – гипоксемия, переходящая в гипоксию. В первую очередь погибают клетки нервной системы, как наиболее чувствительные к недостатку кислорода. Отравление происходит совершенно незаметно.
При легких отравлениях (содержание CO в крови 10-15%) наблюдается биение в висках, головная боль, слабость, тошнота.
При отравлениях средней степени (содержание CO в крови 20-35%) дополнительно появляются нарушения координации движений, посинение кожи лица, потеря сознания.
При тяжелых отравлениях (содержание CO в крови до 60%) происходит потеря сознания, судороги. Смерть наступает от остановки дыхания.
Смертельная концентрация окиси углерода составляет 2 мг/л при экспозиции 1 час или 5 мг/л при экспозиции 5 минут.
Защита органов дыхания – изолирующий противогаз. Фильтрующий противогаз от окиси углерода не защищает. Для обеспечения защиты в качестве противогазовой коробки необходимо использовать специальный дополнительный патрон ДП-1, который снаряжен гопкалитом.
Это окисляющий катализатор, состоящий из 60% MnO2 и 40% CuO.
На его пористой поверхности происходит окисление
CO+MnO2→СО2+MnO.
Восстановление катализатора происходит путем автоокисления кислородом воздуха
2MnO+О2→2MnО2.
Первая помощь: лицам, пораженным окисью углерода, необходим чистый воздух, вдыхание кислорода, сердечные средства, крепкий сладкий чай. В тяжелых случаях делают искусственное дыхание. Антидот «ацизол» вводится внутримышечно как с лечебной, так и с профилактической целью. Действие антидота составляет 3 часа
Азот и его соединения
Азот – по-гречески «не поддерживающий жизнь». Содержание его в земной коре незначительно, около 0,03%. Значительная его часть содержится в воздухе: по объему – 78,09%, по весу – 75,5%.
При обычных условиях азот представляет собой бесцветный газ, не имеет запаха и не представляет угрозы для жизни человека. В виде соединений азот входит во все живые организмы и растения.
Но во многих случаях соединения азота представляют для человека непосредственную опасность.
Соединения азота находят широкое применение в различных отраслях промышленности. Наибольшее их количество расходуется в качестве минеральных удобрений, при производстве взрывчатых веществ, органических красителей, а также различных пластмасс.
К простым соединениям азота относят его соединения с водородом NH3 (аммиак), с кислородом: NO (окись азота), NO2 (двуокись азота), N2O (закись азота) и с хлором NCl (хлористый азот).
 Аммиак (NH3) – бесцветный газ с резким запахом нашатыря, легче воздуха в 1,7 раза, ТК=-33,4°C. Смесь аммиака с воздухом (4:3) взрывоопасна. Аммиак хорошо растворяется в воде. Применяется в холодильной промышленности, а также для производства азотных удобрений. Перевозится и хранится в сжиженном состоянии.
Аммиак (NH3) – бесцветный газ с резким запахом нашатыря, легче воздуха в 1,7 раза, ТК=-33,4°C. Смесь аммиака с воздухом (4:3) взрывоопасна. Аммиак хорошо растворяется в воде. Применяется в холодильной промышленности, а также для производства азотных удобрений. Перевозится и хранится в сжиженном состоянии.
Аммиак обладает острым удушающим рефлекторным действием. При попадании на рецепторы, расположенные в слизистых оболочках, в нервную систему поступает сильный сигнал. На ответные сигналы нервной системы в первую очередь реагирует дыхательная система. Это приводит к спазму легочной ткани, что является причиной развития кислородной недостаточности в организме (развивается гипоксемия, приводящая к гипоксии). В организме нарушается окислительно-восстановительный процесс, что ведет к отмиранию клеток ткани. Первыми погибают клетки нервной системы, как наиболее чувствительные к недостатку кислорода. Кроме того, при вдыхании аммиак попадает в кровь и воздействует на тромбоциты, что нарушает свертываемость крови.
Признаки поражения:
- при малых концентрациях порядка 0,05 мг/м3 наблюдается раздражение слизистых оболочек глаз и верхних дыхательных путей;
- при средних концентрациях происходит поражение глазных тканей, дыхательных путей, наблюдается тошнота, головная боль, одышка, возникает отек легких;
- при высоких концентрациях уже через несколько минут наступает мышечная слабость, судороги, резкое снижение слуха; смерть наступает от нарушения работы сердца и остановки дыхания.
Смертельная концентрация аммиака при минутной экспозиции 0,25 мг/л. При более высоких концентрациях смерть может наступить мгновенно от рефлекторного торможения дыхательного центра.
Среднесуточная ПДК составляет 0,04 мг/м3.
Защита:
- при незначительных концентрациях для защиты органов дыхания можно использовать респиратор РПГ-6М или ватно-марлевую повязку, смоченную в слабом растворе уксусной или лимонной кислоты, при этом необходимо избегать высоких мест;
- при средних концентрациях для защиты органов дыхания используется фильтрующий противогаз типа ГП-7, промышленный противогаз с коробкой имеющей маркировку букв «К» или «М»;
- при высоких концентрациях для защиты органов дыхания используется изолирующий противогаз;
- для нейтрализации аммиака можно использовать растворы минеральных кислот:
NH3+HCl→NH4Cl.
Первая помощь: на пораженного надеть противогаз, вынести из зоны заражения, обеспечить доступ кислорода, обильно промыть глаза водой; при спазме голосовой щели обеспечить тепло в области шеи; для вывода аммиака из легких необходимо вдыхание теплых паров воды или 10% раствора ментола в хлороформе; при удушье – ингаляция кислородом.
Окислы азота.
 Окись азота (NO) – бесцветный газ с удушающим зап а хом, в сжиженном состоянии жидкость синего цвета, при взаимодействии с водой образует азотистую кислоту:
Окись азота (NO) – бесцветный газ с удушающим зап а хом, в сжиженном состоянии жидкость синего цвета, при взаимодействии с водой образует азотистую кислоту:
NO+H2O→HNO2.
Получение азотной кислоты
 Двуокись азота (NO2) – бурый газ с удушающим запахом, в сжиженном состоянии – светло-желтая жидкость, при взаимодействии с водой образует азотную кислоту:
Двуокись азота (NO2) – бурый газ с удушающим запахом, в сжиженном состоянии – светло-желтая жидкость, при взаимодействии с водой образует азотную кислоту:
NO2+ H2 O →HNО3.
Закись азота (N2O) – бесцветный газ со слабым приятным запахом и сладковатым вкусом.
Источником окислов азота в воздухе являются выбросы тепловых электростанций, химических заводов, выхлопы автомобилей, в почве разложение азотосодержащих органических веществ. В выбросах тепловых электростанций в больших количествах содержатся окислы азота и двуокиси серы, которые при соединении с водой возвращаются на землю в виде кислотных дождей.
Механизм действия окислов азота на человека зависит от путей их попадания в организм; в одном случае это механизм удушающего типа, в другом – общеядовитого.
При попадании окислов азота в легкие на влажных стенках дыхательных путей и легких образуется азотная или азотистая кислота, которая разрушает стенки альвеол и капилляров. В результате этого легкие начинают заполняться жидкостью, то есть возникает отек легких. При этом окисел азота вместе с кислородом попадает в кровь, соединяется с гемоглобином крови, что также усиливает отравление организма. Но вероятность отравления человека через легкие невелика из-за высокой влажности воздуха, которая нейтрализует окислы азота.
Чаще всего отравления человека происходят солями азотистой кислоты, которые в организм попадают с продуктами питания и водой.
Соли азотной кислоты называются нитратами. Они образуются путем замены водорода на металл или другой положительный ион.
Нитраты используются в сельском хозяйстве как удобрения почвы.
Наиболее распространенные из них – это нитрат калия KNO (чилийская селитра), нитрат натрия NaNO (индийская селитра) и нитрат аммония
NH4 NO3.
Они менее активно взаимодействуют с другими соединениями и не оказывают существенного влияния на организм.
При нарушении норм внесения азотных удобрений в грунт их концентрация в растениях резко возрастает. При хранении таких растений, особенно овощей, нитраты легко переходят в нитриты – соли азотистой кислоты. Нитриты – это яд для человека и животных. В организме они легко распадаются, выделяя простые соединения такие как окись азота. Окись азота попадает в кровь и вытесняет кислород из гемоглобина, что приводит к кислородному голоданию, т.е. отравлению организма. Возникает болезнь под названием метгемоглобиномия.
Отравление 20% гемоглобина крови приводит к сердечной недостаточности, а 80% – к смерти.
Суточная норма потребления нитратов для взрослого человека составляет 300 – 325 мг, для детей доза гораздо меньше. Относительно легко переносится организмом доза до 200 мг в сутки.
Так как в организм человека нитраты наиболее часто поступают с овощами, то в целях предупреждения отравлений можно дать следующие рекомендации: перед употреблением овощей необходимо проводить проверку на наличие в них нитратов, используя индикаторную бумагу. В соленьях нитратов значительно меньше, чем в свежих овощах; у корнеплодов нитраты концентрируются, в основном, в его верхней части; при термической обработке овощей часть нитратов разлагается, часть переходит в отвар в первые 15 минут.
На высоком уровне остается число групповых отравлений нитратом натрия (консервантом), используемым в производстве колбасных изделий. Его часто ошибочно используют вместо поваренной соли.
Токсичные вещества кожно-нарывного действия
Типичным представителем этой группы является иприт.
Чистый иприт представляет собой бесцветную маслянистую жидкость.
Технический – из-за примесей приобретает окраску темно-коричневого цвета и характерный запах чеснока.
Симптомы: скрытый период составляет 6-12 часов, затем образуются зоны покраснения, в центре которых через 18-24 часа появляются характерные пузыри, которые, сливаясь, захватывают значительные участки кожи; к концу первой недели на месте пузыря образуется струп; через 2-3 недели он отторгается и отпадает.
Поражения тяжелой степени возникают в результате длительного контакта вещества с поверхностью кожи при концентрации вещества на поверхности порядка 0,5 мг/см2 или при действии значительных концентраций вещества в парообразном состоянии порядка 10 мг/л.
Симптомы: характерно глубокое поражение кожи; через 2-3 дня пораженная ткань отторгается с образованием глубоких язвенных ран, заживление которых оттягивается на неопределенный период. Из-за всасывания вещества с поверхности кожи в кровь поражение кожи, как правило, сочетается с общеоотравляющим действием иприта.
Поражение глаз возможно при воздействии на слизистую оболочку даже низких концентраций вещества в парообразном состоянии (порядка 0,001-5мг/л при экспозиции 45 мин). При этом: появляется резь в глазах, обильное слезотечение; через несколько часов слизистые оболочки отекают; может произойти помутнение роговицы.
Поражение дыхательных путей. При вдыхании паров в первую очередь поражаются верхние дыхательные пути, затем бронхи, и, наконец, альвеолы.
Легкая степень поражения: после скрытого периода 10-12 часов возникает ощущение сухости во рту, першение в носу, носоглотке, гортани и сильный сухой кашель.
При поражении средней степени скрытый период сокращается до 5-6 часов, усиливаются начальные симптомы, возникают сильные боли за грудиной и кашель с выделением мокроты.
При тяжелом поражении скрытый период сокращается до 1-2 часов, дополнительно к выше приведенным симптомам добавляется острая бронхопневмония, сопровождающаяся отеком легких. Смерть наступает на 3-4 сутки.
Поражение желудочно-кишечного тракта может произойти при использовании зараженных продуктов или воды.
Проявление: скрытый период 0,5-2 часа, затем появляется сильное слюнотечение, боли в животе, тошнота, рвота. Отравление через желудочно-кишечный тракт опасно, так как токсичное вещество легко всасывается в кровь и быстро начинает оказывать общепоражающее действие.
Защита:
- фильтрующий противогаз надежно защищает органы дыхания и глаза от поражения ипритом;
- для защиты кожи применяется специальная защитная одежда;
- также для защиты кожи можно использовать хлопчатобумажную и другую одежду, но через 3 часа она теряет свои защитные свойства;
- при попадании на кожу или одежду капли иприта необходимо обрабатать раствором из индивидуального противохимического пакета ИПП-8.
Токсичные вещества психохимического действия
Все химические соединения, которые при попадании в организм нарушают функции нервной системы, принято называть токсичными веществами психохимического действия или психотропными.
Токсичные вещества психохимического действия (психотропные) делятся на две группы: вещества, вызывающие временные физические поражения, например, паралич, слепоту или глухоту, и вещества, вызывающие временные психические расстройства, например, страх, безудержный смех, безрассудное поведение, галлюцинации.
Механизм токсического действия этих веществ связан с подавлением активности некоторых ферментов центральной нервной системы (ЦНС). После попадания в организм этих веществ первые симптомы поражения проявляются через 10-15 минут, которые затем усиливаются, и через 2-4 часа достигают максимума. После этого к исходу первых суток наблюдается постепенное затухание симптомов поражения.
Нарушения ЦНС при воздействии веществ психохимического действия весьма разнообразны и зависят от токсодозы и индивидуальных особенностей организма.
При вдыхании аэрозоля или попадании внутрь организма через желудочно-кишечный тракт психохимические вещества первоначально вызывают: ощущение слабости, головокружение, чувство давления на уши и глаза, ощущение жары и холода, учащаются пульс и дыхание, появляется слюнотечение, слезотечение, покраснение кожи лица.
Эти изменения постепенно перерастают в расстройство эмоциональной деятельности и двигательной активности, помрачение сознания, нарушение чувства реальности, появляются зрительные галлюцинации.
Конкретный характер симптомов психических проявлений при этом не поддается определенному прогнозированию. Выход из состояния психоза происходит, как правило, самостоятельно, нередко после глубокого сна.
Применение медикаментозных средств позволяет облегчить течение психоза и ускоряет нормализацию утраченных функций.
Однако следует отметить, что психические яды охватывают несколько групп веществ разного химического строения, поэтому различие симптомов поражения каждой из групп препятствует быстрой диагностике и делает очень часто невозможным использование стандартных средств оказания необходимой помощи и лечения.
К группе веществ психохимического действия относится вещество LSD (диэтиламид лизергиновой кислоты): твердое вещество, не имеет запаха и вкуса. Минимально действующая доза (пороговая) 0,035 мг на человека.
Другими представителями этой группы являются мескалин, который содержится в табаке, и псилоцибин, содержащийся в некоторых видах южноамериканских грибов.
Токсичные вещества раздражающего действия
Типичными представителями раздражающих веществ являются хлорацетофенон (CN), адамсит (DM), вещество си-эс (CS), вещество си-ар (CR) и др.
К группе раздражающих веществ можно отнести красный перец, жгучий вкус которому придает капсаицин.
Си-эс (CS) – твердое, бесцветное вещество со специфическим, похожим на перец, вкусом и запахом сирени, плотность – 1,04 г/см3, плотность пара по воздуху 6.5, ТК=315° С, ТПЛ=65° С; термически устойчивое до температуры 300° С.
Аэрозоль CS оказывает сильное раздражающее действие на слизистые оболочки глаз, верхних дыхательных путей, которое проявляется в виде обильного слезотечения, мучительного жжения в области носоглотки и загрудинной боли.
Часто поражение сопровождается покраснением кожи, особенно влажной. При выходе из зараженной зоны явления раздражения слизистых оболочек проходят через 5-15 минут, покраснение кожи сохраняется до нескольких часов.
Первые признаки поражения проявляются при C=0,002 мг/л, концентрация C=0,005 мг/л непереносима при времени экспозиции до 1 минуты. При концентрациях C=2,7 мг/л наблюдаются поражения легких.
Практическое применение находят две рецептуры:
рецептура CS-1, которая сохраняет свое поражающее действие до 5 суток, состоящая собственно из CS в порошкообразном состоянии и 5% силикагеля, представляющего собой тонкий микроскопический порошок, предотвращающий комкование;
рецептура CS-2, которая представляет собой рецептуру CS-1 обработанную водоотталкивающим силиконом, в результате чего она приобретает повышенную сыпучесть, устойчивость к метеорологическим воздействиям и сохраняет раздражающие свойства до 1,5 месяцев после применения.
Си-ар (CR) – порошок желтого цвета, плотность – 1 г/см3, плотность пара по воздуху 6.7, ТК=339°C, ТПЛ=72°C.
Хорошо взаимодействует с любыми окислителями (перекисью водорода, хлораминами, перманганатом и др.). Обладает сильным раздражающим действием глаз, носоглотки и кожных покровов. При контакте аэрозоля со слизистыми оболочками глаз возникают обильное слезотечение, резь в глазах, возможна временная потеря зрения. Вдыхание аэрозоля вызывает сильный кашель, чихание, насморк. При попадании на кожные покровы степень поражения зависит от дозы вещества и влажности кожи.
После выхода из зоны заражения по сравнению с CS признаки поражения проходят быстрее. Однако по раздражающему воздействию действие CR сильнее, чем действие CS.
Пороговая концентрация CR C=0,0002 мг/л, непереносимая C=0,003 мг/л при экспозиции в течение 1 минуты.
Хлорацетофенон представляет собой бесцветное кристаллическое вещество с приятным запахом цветущей черемухи. Технический продукт может иметь окраску от соломенно-желтого до серого цвета, плотность 1,321 г/см3, плотность пара по воздуху 5.3, ТК=245°C, ТПЛ=59°C. Практически не взаимодействует с водой, термически стабилен. Нагревание в течение 15 минут при 300°C вызывает пиролиз (разложение) лишь 1,5% вещества. Устойчиво к детонации, в расплаве смешивается с взрывчатыми веществами. Это свойство позволяет переводить его в аэрозольное состояние путем термической возгонки из пиротехнических смесей (граната, патрон).
Пороговая концентрация С=0,0005 мг/л, непереносимая С=0,002 мг/л при экспозиции в течение 1 минуты.
Условные названия и шифры: в США – «CN», в Великобритании – «САР», в Германии – «O-SALZ» и во Франции – «Grandite».
В настоящее время раздражающие вещества используются в газовом оружии. Тип заряда можно определить по окраске пыжа или донышка патрона: желтый цвет – CS; белый, голубой, фиолетовый – CN, зеленый – шумовой заряд; любой другой – холостой или для выстреливания сигнальных звездочек. Газовый баллончик «Риокон-250» снаряжается веществом CN
(г. Ижевск).
Защита:
- фильтрующий противогаз хорошо защищает органы дыхания и лицо от действия раздражающих веществ;
- дегазация раздражающих веществ может быть проведена с использованием водного раствора хлорной извести,
Не нашли, что искали? Воспользуйтесь поиском: