
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Предмет коллоидной химии
Наука о поверхностных явлениях и дисперсных системах называется коллоидной химией.
К поверхностным явлениям относятся процессы, происходящие на поверхности раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз. Каждое тело ограничено поверхностью, поэтому объектами коллоидной химии могут быть тела любого размера. Однако поверхностные явления проявляются сильнее всего в телах с высокоразвитой поверхностью, которая придает им новые важные свойства.
Дисперсные системы, рассматриваемые в коллоидной химии, состоят как минимум из двух фаз. Одна из них является сплошной и называется дисперсионной средой. Другая фаза раздроблена и распределена в первой, ее называют дисперсной фазой [1].
Классификация дисперсных систем
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсной фазы и дисперсионной среды. Три агрегатных состояния (твердое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл. 1.1). Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды. Например, дробью Т/Ж обозначают системы с твердой дисперсной фазой и жидкой дисперсионной средой (твердое в жидкости). Одно из девяти сочетаний Г/Г в обычных условиях не может образовать коллоидной системы, так как газы при любых соотношениях дают истинные растворы. Однако и газы могут проявлять некоторые свойства коллоидных систем благодаря непрерывным флуктуациям плотности и концентрации, вызывающим неоднородности в системе.
Из представленной классификации видно, что все дисперсные системы по кинетическим свойствам дисперсной фазы можно разделить на два класса: свободнодисперсные системы, в которых дисперсная фаза подвижна, и связнодисперсные системы – системы с твердой дисперсионной средой, в которой частицы дисперсной фазы не могут свободно передвигаться. К свободнодисперсным системам относятся золи, к связнодисперсным – гели.
Дисперсные системы классифицируют по дисперсности. Для свободнодисперсных и связнодисперсных систем классификации по дисперсности имеют существенные различия.
Таблица 1.1
Классификация дисперсных систем по агрегатному состоянию фаз
| Условное обозначение системы | Название системы и примеры |
| Т/Т | Твердые гетерогенные системы: минералы, сплавы, бетон, композиционные материалы |
| Ж/Т | Капиллярные системы: жидкость в пористых телах, адсорбенты в растворах, почвы, грунты |
| Г/Т | Пористые тела: адсорбенты и катализаторы в газах |
| Т/Ж | Суспензии и золи: промышленные суспензии, пульпы, взвеси, пасты, илы |
| Ж/Ж | Эмульсии: природная нефть, кремы, молоко |
| Г/Ж | Газовые эмульсии и пены: флотационные, противопожарные, мыльные пены |
| Т/Г | Аэрозоли (пыли, дымы), порошки |
| Ж/Г | Аэрозоли, туманы, в том числе промышленные, облака |
| Г/Г | Коллоидные системы отсутствуют |
Свободнодисперсные системы подразделяются на ультрамикрогетерогенные, размер частиц которых лежит в пределахот 10–7 до 10–5 см (от 1 до 100 нм), микрогетерогенные с размером частиц от 10–5 до 10–3 см (от 0,1 до 10 мкм) и грубодисперсные с частицами, размер которых превышает 10–3 см.
Ультрамикрогетерогенные системы часто называют истинно коллоидными или просто коллоидными, так как раньше только такие системы считались объектом коллоидной химии. Сейчас термин «коллоидный» стал применяться в широком смысле, равноценном термину «гетерогенно-дисперсный», а за ультрамикрогетерогенными системами осталось название «золи».
Связнодисперсные системы, точнее, пористые тела, классифицируют на микропористые – с размерами пор до 2 нм, переходно-пористые – от 2 до 200 нм и макропористые – выше 200 нм. Системы Т/Т часто удобнее подразделять по дисперсности так же, как и свободнодисперсные системы.
По термодинамической устойчивости дисперсные системы классифицируют на лиофильные (термодинамически устойчивые) и лиофобные (термодинамически неустойчивые) [2].
Методы получения дисперсных систем
Лиофобные дисперсные системы (термодинамически неравновесные) могут быть получены двумя путями: конденсацией молекул и дроблением более крупных частиц до нужной степени дисперсности.
Конденсационный путь образования дисперсных систем связан с выделением новой фазы из гомогенной системы, находящейся в метастабильном состоянии, например, кристаллизация из пересыщенного раствора, конденсация пересыщенного пара и т. п. Этот процесс протекает в том случае, если химический потенциал вещества в новой (стабильной) фазе меньше, чем в старой (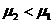 ). Однако этот выгодный в конечном счете процесс проходит через стадию, требующую затраты энергии, – стадию образования зародышей новой фазы. Условия для возникновения зародышей новой фазы возникают в метастабильной системе в местах, где образуется местное пересыщение –флуктуации плотности (концентрации) достаточной величины. Радиус равновесного зародыша новой фазы связан со степенью пересыщения известной зависимостью (для жидкой капельки, образующейся в пересыщенном паре):
). Однако этот выгодный в конечном счете процесс проходит через стадию, требующую затраты энергии, – стадию образования зародышей новой фазы. Условия для возникновения зародышей новой фазы возникают в метастабильной системе в местах, где образуется местное пересыщение –флуктуации плотности (концентрации) достаточной величины. Радиус равновесного зародыша новой фазы связан со степенью пересыщения известной зависимостью (для жидкой капельки, образующейся в пересыщенном паре):
 =
= 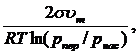 (1.1)
(1.1)
где s и 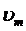 – поверхностное натяжение и молярный объем жидкой капельки; p
– поверхностное натяжение и молярный объем жидкой капельки; p  и p
и p  – упругости пересыщенного и насыщенного пара соответственно.
– упругости пересыщенного и насыщенного пара соответственно.
Из уравнения видно, что для образования зародышей новой фазы необходимо пересыщение p  /p
/p  >1. Чем больше степень пересыщения, тем меньше равновесный размер зародышей, тем легче он образуется.
>1. Чем больше степень пересыщения, тем меньше равновесный размер зародышей, тем легче он образуется.
Размеры образующихся частиц зависят от условий проведения процесса конденсации, в принципе – от соотношения между скоростями одновременно идущих процессов: образование зародышей и роста их. Для получения мелких частиц (т. е. частиц дисперсной фазы в будущей дисперсной системе) необходимо значительное преобладание скорости первого процесса над скоростью второго. Практически такие условия создаются либо в весьмав разбавленных растворах реагирующих веществ, либо, наоборот, в достаточно концентрированных растворах, когда образуется сразу много зародышей в процессе кристаллизации, не успевших вырасти до больших размеров. В первом случае образуется золь (коллоидная система), во втором получается мелкокристаллический осадок, который можно в определенных условиях перевести в коллоидный раствор.
Химическая конденсация
Если при химической реакции образуется труднорастворимое соединение, то оно при определенных условиях может быть получено в виде коллоидного раствора. Для этого нужно, во-первых, вести реакцию, разбавленную в растворе, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10  ¼10
¼10  м) и системе будет обеспечена седиментационная устойчивость; во-вторых, одно из реагирующих веществ взять в избытке, чтобы на поверхности кристалла мог образоваться двойной электрический слой –основной фактор агрегативной устойчивости [2].
м) и системе будет обеспечена седиментационная устойчивость; во-вторых, одно из реагирующих веществ взять в избытке, чтобы на поверхности кристалла мог образоваться двойной электрический слой –основной фактор агрегативной устойчивости [2].
Физическая конденсация
В основе способа лежит конденсация молекул одного вещества – будущей дисперсной фазы, в другом веществе – будущей дисперсионной среды. Практически это может быть осуществлено различными путями, например пропусканием одного вещества в другое.
Одним из примеров физической конденсации является метод замены растворителя: раствор какого-либо вещества постепенно, при перемешивании, прибавляют к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц.
Таким способом можно получить гидрозоли серы, фосфора, канифоли, антрацена и других веществ, вливая их спиртовые растворы в воду. Строение двойного электрического слоя в этих системах недостаточно известно [2].
Дробление
Механическое дробление осуществляется в различного рода мельницах (для получения коллоидной дисперсности применяют дисперсные мельницы), с помощью ультразвука, в вольтовой дуге (для получения золей металлов) и т. д.
Дробление частиц малых размеров требует большой затраты работы, так как поверхность раздела между фазами в таких системах должна быть очень велика. Образующиеся при дроблении частицы имеют тенденцию самопроизвольного слипания (коагуляции), поэтому дробление следует производить в дисперсной среде в присутствии стабилизаторов-ионов или поверхностно-активных веществ.
Дробление в присутствии поверхностно-активного вещества (ПАВ) требует меньшие затраты работы. Эффект значительного понижения сопротивляемости твердых тел разрушения в результате адсорбции ПАВ был обнаружен Ребиндером П. А. и получил название адсорбционного понижения прочности [2].
Физико-химическое дробление осадков (пептизация)
Пептизацией называют дробление рыхлых осадков, в которых имеются отдельные частицы дисперсной фазы, разделенные прослойками дисперсионной среды. Их непосредственному прикосновению мешают либо двойные электрические слои, либо сольватные оболочки на поверхности частиц. Они обеспечивают отталкивание частиц до близких расстояний, тогда как на более далеких преобладают силы внешнего межмолекулярного притяжения, не дающие частицам разойтись за счет теплового движения.
Следует иметь в виду, что в некоторых случаях дисперсные системы могут образовываться путем самопроизвольного диспергирования дисперсной фазы в дисперсионной среде. Такие системы являются термодинамически равновесными и не требуют стабилизации; их называют лиофильными коллоидными системами [2].
ПРАКТИЧЕСКАЯ ЧАСТЬ
Получение золей серы и канифоли
Цель работы
Получить золи методом замены растворителя.
Реактивы
1. Канифоль, 2%-ный раствор в этаноле.
2. Сера, насыщенный раствор в этаноле.
Не нашли, что искали? Воспользуйтесь поиском: