
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Контрольная работа №1. Тема направлена на промежуточный контроль сформированности компетенций ОК-1; ПК-1; ПК-2; ПК-3; ПК-27; ПК-31; ПК-32.
Значение темы:
Тема направлена на промежуточный контроль сформированности компетенций ОК-1; ПК-1; ПК-2; ПК-3; ПК-27; ПК-31; ПК-32.
Цель: Контроль и проверка знаний и умений по темам: «Основные законы химии. Классификация и номенклатура неорганических соединений. Способы выражения концентрации растворов. Основы количественного анализа», «Строение вещества. Элементы химической термодинамики и биоэнергетики», «Элементы химической термодинамики и биоэнергетики», «Химическая кинетика и катализ. Химическое равновесие», «Учение о растворах. Коллигативные свойства растворов», «Протолитические процессы. Свойства буферных систем. Комплексообразование. Свойства комплексных соединений. Гетерогенное равновесие», «Окислительно-восстановительное равновесие», «Химия биогенных элементов. Свойства s-элементов. Свойства d-элементов. Свойства р-элементов».
Форма организации учебного процесса: практическое занятие.
Место проведения занятия: учебно-научная химическая и биохимическая лаборатория.
Оснащение занятия: интерактивная доска, проекционное оборудование, справочная литература.
План проведения занятия:
| 1. | Организационная часть | 5 мин |
| 2. | Выполнение компьютерного тестирования | 20 мин |
| 3. | Выполнение заданий на билет к контрольной работе | 135 мин |
| 4. | Собеседование | 15 мин |
| 5. | Домашнее задание | 5 мин |
Вопросы для контрольной работы:
1. Техника безопасности и правила работы в химической лаборатории. Меры оказания первой помощи и правила поведения при несчастных случаях. Предмет и задачи химии. Место химии в системе естественных наук. Связь химии с медициной. Основные этапы развития химии. Вклад отечественных и зарубежных ученых в развитие химии.
2. Современные представления о природе электрона. Характеристика энергетического состояния электрона с использованием квантовых чисел. Квантово-механическая модель атома.
3. Основные принципы заполнения электронной структуры атома (принцип минимума энергии). Деление атомов по подобию энергетических уровней на s-, p-, d-, f-семейства. Электронные и графические формулы для атомов и ионов.
4. Типы химических связей. Принцип образования ковалентной химической связи. Метод валентных связей. Природа σ- и π-связей. Понятие о гибридизации атомных орбиталей. Взаимосвязь типа гибридизации и структуры молекул. Водородная связь.
5. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное.
6. Классификация и номенклатура основных классов неорганических соединений. Валентность. Графические формулы веществ.
7. Применение в химии законов сохранения массы и энергии. Вещество. Количественная и качественная информация, содержащаяся в химических формулах и уравнениях. Закон постоянства состава и его современная трактовка. Закон кратных отношений. Закон Авогадро.
8. Определение понятий: эквивалент, фактор эквивалентности, количество вещества эквивалента, молярная масса эквивалента.
9. Способы выражения концентрации растворов: а) Массовая доля; б) Молярная концентрация; в) Молярная концентрация эквивалента; г) Молярная доля растворенного вещества; д) Моляльная концентрация; е) Титр вещества. Формулы перехода от одних способов выражения концентрации к другим. Закон эквивалентов.
10. Задачи количественного анализа. Классификация методов количественного анализа. Разновидность количественного анализа – титриметрический анализ. Классификация титриметрического анализа по типу химической реакции (кислотно-основное, осадительное, окислительно-восстановительное, комплексонометрическое); по типу титранта.
11. Требования к реакциям, применяемым в титриметрическом анализе. Основные понятия: титрант, титрование, точка эквивалентности, точка конца титрования. Способы проведения анализа (прямое, заместительное, обратное), приемы проведения анализа (отдельных навесок, аликвотных проб (пипетирования)).
12. Способы выражения концентрации титрованных растворов, способы их приготовления. Стандартные (установочные, исходные) вещества. Требования, предъявляемые к стандартным веществам. Решение расчетных задач.
13. Теоретические основы, сущность алкалиметрического, ацидиметрического, перманганатометрического, йодометрического титрования. Используемые титранты, концентрация, способы их приготовления, стандартные вещества, способы фиксирования точки эквивалентности, индикаторы. Индикаторы метода кислотно-основного титрования. Интервал перехода окраски индикаторов.
14. Оборудование в титриметрическом анализе. Виды мерной химической посуды и приемы работы с ними. Правила работы с оборудованием. Расчетные формулы, используемые в титриметрическом анализе согласно системе СИ.
15. Осадительное титрование. Окислительно-восстановительное титрование. Комплексонометрическое титрование.
16. Термодинамика, основные понятия и задачи. Параметры состояния (экстенсивные и интенсивные) и функции состояния системы.
17. Понятие внутренней энергии. Работа и теплота – две формы передачи энергии. Первое начало термодинамики. Изохорные и изобарные процессы. Тепловой эффект химической реакции. Энтальпия как функция состояния системы. Эндотермические и экзотермические процессы.
18. Первое начало термодинамики для изобарных процессов. Закон Гесса. Термохимические расчеты и их использование для энергетической характеристики химических и биохимических процессов. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса.
19. Энергетическая ценность пищевых продуктов, обоснование рационов питания, основные задачи биоэнергетики.
20. Второе начало термодинамики, вклад С. Карно и Р. Клаузиуса. Энтропия как функция состояния системы. Критерии самопроизвольно протекающих процессов в изолированных системах. Связь энтропии с вероятностью состояния системы.
21. Применение первого и второго начала термодинамики к живым организмам. Математическое выражение второго начала термодинамики для открытых систем. Энергия Гиббса как функция состояния системы и критерий направленности процессов. Условия возможности протекания реакций в прямом направлении. Математическое выражение, связывающее изменение энергии Гиббса с изменениями энтальпии и энтропии. Расчет изменения энергии Гиббса по следствиям закона Гесса.
22. Экзергонические и эндергонические реакции. Понятие о сопряженных процессах. Коэффициент полезного действия биохимических процессов.
23. Зависимость энтальпии процесса от температуры. Энергия Гельмгольца. Уравнения Гиббса-Гельмгольца. Термодинамика открытых систем.
24. Понятие о скорости химической реакции. Закон действующих масс.
25. Молекулярность и порядок реакции.
26. Влияние различных факторов на скорость химической реакции. Фармакокинетика.
27. Кинетические уравнения реакций нулевого, первого, второго порядков. Размерность константы скорости. Период полураспада. Кинетика сложных реакций.
28. Фотохимические реакции.
29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
30. Энергия активации. Катализ. Катализаторы. Механизм их действия. Основы гомогенного катализа. Кислотно-основный катализ. Кинетика ферментативного катализа. Зависимость скорости реакции от концентрации фермента и субстрата. Кинетическое уравнение Михаэлиса-Ментена.
31. Обратимые и необратимые химические реакции. Условия возникновения химического равновесия. Признаки истинного химического равновесия.
32. Химический потенциал: физический смысл и математическое выражение.
33. Вывод закона действующих масс для химического равновесия. Константа химического равновесия, способы ее выражения.
34. Уравнения изотермы и изобары химической реакции. Влияние температуры на величину константы химического равновесия. Прогнозирование смещения химического равновесия. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
35. Понятие о стационарном состоянии живого организма, его характеристика. Сходство и отличие стационарного состояния от химического равновесия. Гомеостаз и адаптация организма.
36. Виды катализа в биохимических реакциях. Гомеостаз и его характеристики.
37. Принцип Ле-Шателье, практическое применение.
38. Растворы, определение. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее роль в качестве единственного биорастворителя. Строение воды, образование межмолекулярных водородных связей.
39. Механизм и термодинамика процесса растворения. Растворение в жидкостях твердых, жидких и газообразных веществ. Характер изменения энтальпии и энтропии в процессе растворения. Насыщенные, ненасыщенные и пересыщенные растворы.
40. Растворимость, единицы ее измерения. Влияние температуры на процесс растворения.
41. Законы Генри, Дальтона и Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови.
42. Коллигативные свойства разбавленных растворов.
43. Диффузия. Закон Фика. Роль диффузии в процессах переноса веществ в биологических системах. Давление пара над раствором, причины его уменьшения. Закон Рауля.
44. Относительное понижение давления пара над раствором. Повышение температуры кипения растворов. Формулы расчета. Эбулиометрическая константа, эбулиометрический способ расчета молярной массы растворенного вещества. Понижение температуры замерзания растворов. Формулы расчета. Криометрическая константа, криометрический способ расчета молярной массы растворенного вещества.
45. Осмос. Условия, необходимые для проявления осмоса, механизм. Осмотическое давление, формулы расчета. Уравнение Вант-Гоффа. Роль осмоса и осмотического давления в биологических системах. Изотонические, гипертонические и гипотонические растворы, их применение в медицине. Гемолиз и плазмолиз.
46. Коллигативные свойства растворов электролитов. Изотонический коэффициент. Причина отклонения растворов электролитов от законов Рауля и Вант-Гоффа. Уравнение, связывающее степень диссоциации и изотонический коэффициент.
47. Основные положения протолитической теории кислот и оснований. Кислоты и основания по Бренстеду-Лоури, сопряженные кислоты и основания. Константы кислотности и основности. Показатели кислотности (рКа) и основности (рКв).
48. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели, рН биологических жидкостей. Расчет рН и рОН сильных и слабых электролитов. Изменение рН органов и тканей при различных заболеваниях. Ацидоз. Алкалоз. Способы их устранения. Лекарственные препараты, используемые для устранения алкалоза и ацидоза.
49. Буферные системы. Механизм буферного действия систем I и II типа. Расчет рН буферных систем при добавлении сильной кислоты или сильного основания.
50. Буферное действие. Буферная емкость. Расчет буферной емкости по кислоте и по основанию. Факторы, влияющие на буферную емкость.
51. Буферные системы крови. Сравнительная буферная емкость буферных систем крови. Бикарбонатная, фосфатная, белковая, гемоглобиновая буферные системы. Механизм действия. Формулы для расчета рН.
52. Гидролиз солей, АТФ, константы гидролиза. Роль гидролиза в биохимических процессах.
53. Комплексные соединения. Координационная теория Вернера. Строение комплексных соединений. Классификация и номенклатура. Получение комплексных соединений.
54. Внутрикомплексные соединения и их роль в биологических процессах. Полидентатные лиганды. Строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы. Токсичность солей тяжелых металлов, взаимодействие их с комплексами биогенных металлов.
55. Антидоты: унитиол, комплексоны, британский антилюизит (БАЛ), тетацин, пенициламин.
56. Устойчивость комплексных соединений в растворах. Первичная и вторичная диссоциация комплексных соединений. Константа устойчивости и константа нестойкости комплексного иона и их взаимосвязь с устойчивостью комплекса.
57. Комплексонометрическое титрование. Определение жесткости воды комплексонометрическим методом. Динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) – трилон Б. Металлиндикаторы – кислотный хромовый черный (эриохром черный Т).
58. Гетерогенные равновесия и процессы. Константа растворимости. Условия образования и растворения осадков. Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов.
59. Механизм функционирования кальциевого буфера. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.
60. Классификация и сущность методов осадительного титрования. Аргентометрия.
61. Электронная теория окислительно-восстановительных реакций (ОВР) (Л.В. Писаржевский). Окислительно-восстановительные свойства элементов и их соединений в зависимости от положения элемента в Периодической системе элементов и степени окисления элементов в соединениях.
62. Сопряженные пары окислитель-восстановитель. Окислительно-восстановительная двойственность. Типы окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования. Составление окислительно-восстановительных реакций методом электронного и ионно-электронного баланса.
63. Механизм возникновения электродного и редокс-потенциалов. Стандартные, реальные, формальные электродные и окислительно-восстановительные потенциалы (редокс-потенциалы). Уравнение Нернста-Петерса. Сравнительная сила окислителей и восстановителей.
64. Стандартное изменение энергии Гиббса и Гельмгольца окислительно-восстановительной реакции. Прогнозирование направления протекания ОВ реакций по разности ОВ потенциалов. Влияние лигандного окружения центрального атома на величину редокс-потенциала. Влияние среды и внешних условий на направление окислительно-восстановительных реакций и характер образующихся продуктов.
65. Классификация и сущность методов окислительно-восстановительного титрования. Перманганатометрия, йодометрия.
66. Строение гемоглобина, каталазы, цианкобаламина и цитохромов. Их применение в медицине.
67. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Механизм действия редокс-буферных систем.
68. Токсическое действие окислителей (нитраты, нитриты, оксиды азота). Обезвреживание кислорода, пероксида водорода, супероксид-иона. Применение редокс-реакций для детоксикации.
69. Совмещенные равновесия и конкурирующие процессы разных типов. Константа совмещенного равновесия.
70. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни.
71. Классификация химических элементов в организме по В.И. Вернадскому. Роль макро- и микроэлементов в живом организме.
72. Концентрирование химических элементов в органах, тканях и биологических жидкостях человека. Эндемические заболевания.
73. Содержание в организме, топография, биологическая роль лития, натрия, калия, кальция, магния, алюминия, бора, бария, углерода, кремния, азота, фосфора, мышьяка, кислорода, хлора, серы, фтора, брома, йода, меди, серебра, золота, цинка, молибдена, марганца, железа, хрома, кобальта.
74. Общая характеристика s-элементов. Изменение активности s-элементов в главной подгруппе. Степени окисления, особенности лития и бериллия. Оксиды, надпероксиды, пероксиды щелочных металлов. Биологическая роль s-элементов и применение соединений натрия, калия, кальция, магния и бария в медицине.
75. Общая характеристика d-элементов. Изменение химической активности d-элементов в подгруппах в направлении сверху вниз. Закономерности изменения кислотно-основных и окислительно-востановительных свойств d-элементов в зависимости от степени окисления. Характерные степени окисления для d-элементов, встречающихся в организме.
76. Общая характеристика элементов VIБ группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений хрома в степени окисления +2, +3, +6. Биологическая роль Cr+3, Mo+6. Ксантиноксидаза и альдегидоксидаза – ферменты, содержащие Mo+6.
77. Общая характеристика элементов VIIБ группы. Электронные формулы для марганца, технеция и рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2, +4, +6, +7. Окислительная активность перманганат-иона в зависимости от среды. Биологическая роль Mn+2.
78. Общая характеристика d-элементов IIБ группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Амфотерный характер цинка, его оксида и гидроксида. Строение комплексных соединений данных элементов. Биологическая роль Zn+2. Карбоангидраза, карбоксипептидаза – биологически значимые ферменты, их роль в организме. Хелатотерапия. Соединения цинка и ртути, применяемые в медицине. Токсическое действие на организм ртути и кадмия.
79. Общая характеристика р-элементов. Строение электронной структуры для р-элементов. Характер изменения свойств р-элементов по периодам и подгруппам. Наиболее характерные степени окисления. Правило ”четности”. Органогенные р-элементы. Макроэлементы.
80. Свойства р-элементов IIIА группы. Изменение активности элементов в подгруппе. Степени окисления. Бор и борные кислоты. Особенности борной кислоты. Амфотерный характер алюминия, его оксида и гидроксида. Биологическая роль Al+3. Соединения алюминия, применяемые в медицине.
81. Свойства р-элементов IVА группы. Электронные формулы и степени окисления. Биологическая роль углерода и кремния. Германий, олово – микроэлементы. Токсическое действие на организм свинца и его соединений.
82. Свойства р-элементов VА группы. Азот, свойства соединений азота в отрицательных степенях окисления: нитриды, гидразин, гидроксиламин, кислородные соединения и соответствующие им кислоты, соли. Токсическое действие нитратов, нитритов, оксидов азота. Фосфор, кислородные соединения, соответствующие им кислоты. Состав и биологическая роль АТФ и АДФ. Кислородные соединения мышьяка, кислоты и соли мышьяка. Биологическая роль As+5. Токсическое действие As+5. Реакция Марша.
83. Свойства серы и ее соединений. Действие тяжелых металлов на серосодержащие ферменты. Свойства сероводорода, его токсичность. Сернистая, серная и тиосерная кислоты.
84. Галогены. Электронные формулы, степени окисления. Водородные соединения галогенов. Кислородные соединения хлора. Хлорная вода. Жавелевая вода. Хлорная известь. Биологическая роль ионов F-, Cl-, Br-, I-. Применение соединений галогенов в медицине.
85. Механизмы образования активных форм кислорода в организме человека.
Ситуационные задачи к контрольной работе:
1. Сколько мл раствора серной кислоты с массовой долей 98% (r = 1,84 г/мл) необходимо взять для приготовления 200 мл раствора с массовой долей 10% (r = 1,05 г/мл)?
2. Вычислите массовую долю и молярную концентрацию раствора глюкозы, содержащего 75 г вещества в 500 г воды.
3. Чему равна молярная концентрация 0,9% раствора хлорида натрия (r = 1,0 г/мл)?
4. Как приготовить 5% раствор глюкозы из 20% раствора?
5. Концентрация глюкозы в сыворотке крови равна 3,5 ммоль/л, выразите концентрацию в мг%.
6. Рассчитайте концентрацию ионов первичной слюны в г/л, если С(Na+) = 140 ммоль/л, С(K+) = 10 ммоль/л, С(Cl-) = 110 ммоль/л, С(HCO3-) = 40 ммоль/л.
7. В норме за сутки с мочой выделяется 20-35 г мочевины CO(NH2)2, рассчитайте количество мочевины в молях. Гипер- или гипоурикемия наблюдается, если выделение мочевины составляет 590 ммоль/сут.?
8. Гидроперит (содержит перекись водорода и мочевину) применяют как антисептическое средство. Одна таблетка соответствует 15 мл 3% раствора перекиси водорода. Сколько таблеток необходимо растворить в 180 мл воды для получения 1% раствора (r = 1,0 г/мл)?
9. Для лечения впервые выявленных больных деструктивным туберкулезом вводят внутривенно 10% раствор изониазида из расчета 15 мг/кг массы тела. Рассчитайте объем в мл 10% раствора изониазида (r = 1,0 г/мл), который необходимо ввести больному массой 75 кг.
10. Тактивин – лекарственный препарат полипептидной природы используется в медицинской практике как иммуномодулирующее средство. Форма выпуска: 0,01% раствор во флаконах по 1 мл. При офтальмогерпесе препарат назначают в виде подкожных инъекций по 0,010-0,025 мг один раз в сутки. Рассчитайте объемы 0,01% раствора тактивина, которые соответствуют суточной дозе препарата.
11. Ампициллин – полусинтетический антибиотик. Форма выпуска: таблетки и капсулы по 0,25 г. Суточная доза для детей составляет 100 мг/кг. Суточную дозу делят на 4-6 приемов. Рассчитайте, какую часть таблетки нужно дать ребенку массой 10 кг на один прием: а) при четырехкратном приеме; б) при шестикратном приеме препарата в сутки.
12. Для определения общей кислотности желудочного сока 5 мл сока оттитровали раствором щелочи с концентрацией 0,095 моль/л в присутствии фенолфталеина. На реакцию израсходовано 2,5 мл раствора щелочи. Рассчитайте кислотность анализируемого сока в моль/л.
13. Рассчитайте массу навески КMnO4, необходимую для приготовления: а) 1 л раствора KMnO4 с молярной концентрацией эквивалента 0,1 моль/л, б) 0,5 л раствора KМnO4 c молярной концентрацией эквивалента 0,05 моль/л для проведения работ по перманганатометрическому титрованию.
14. Для определения кальция в сыворотке крови его осаждают в виде СаС2О4, добавляя к 0,5 мл сыворотки оксалат аммония в избытке. Осадок отфильтровывают, промывают и растворяют в серной кислоте. Раствор титруют раствором KMnO4 c молярной концентрацией эквивалента 0,01 моль/л до неисчезающего розового окрашивания. Вычислите содержание кальция в миллимолях на 1 л сыворотки, если на титрование 0,5 мл сыворотки израсходовано 5 мл KMnO4.
15. Рассчитайте массовую долю (%) уксусной кислоты, если на 10 мл ее раствора израсходовано при титровании 20 мл 0,2 моль/л раствора гидроксида натрия.
16. На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720 г воды?
17. Почему реакция окисления глюкозы до глюкозо-6-фосфат, являясь эндергонической, протекает в организме в прямом направлении?
18. В организме человека реакция окисления этилового спирта протекает в две стадии. Первая – окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2Н5ОН + 1/2О2 = СН3СОН + Н2О. Рассчитайте ΔНр-ии, используя первое следствие закона Гесса.
19. Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы: С6Н12О6 = 2С2Н5ОН + 2СО2.
20. Теплота сгорания углеводов, белков и жиров составляет 17; 17 и 39 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – юношей составляет 113; 106 и 451 г. Какова суточная потребность студентов – юношей в энергии?
21. Почему процесс денатурации белка трипсина при 500С является самопроизвольным, хотя тепловой эффект реакции равен 2725 Дж/моль? Изменение энтропии для данной реакции 8,8 Дж/(моль·К).
22. Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы, используя справочные данные.
23. Константа равновесия разложения лекарственного вещества в автоклаве при 413 К равна 0,396·105 Па, а при 443 К – 1,286·105 Па. Вычислите тепловой эффект реакции. Рассчитайте константу равновесия, если ∆G0298 для данной реакции равно – 4,478 кДж/моль.
24. Фармпрепарат при 500С в воде подвергается термическому разложению по уравнению первого порядка с константой скорости 0,071 мин-1. Сколько времени нужно нагревать раствор при 500С для того чтобы исходная концентрация вещества, равная 0,01 моль/л уменьшилась до 0,001 моль/л?
25. Константа скорости реакции гидролиза трипептида аланилглицилглицина, которая протекает как реакция первого порядка, равна 0,0116 мин-1. Какое количество исходного вещества (в процентах) прореагирует за 1 час?
26. Реакция разложения пероксида водорода в водном растворе протекает как реакция первого порядка. Период полураспада при данных условиях 15,86 мин. Определите, какое время требуется для разложения 99% взятого количества пероксида водорода.
27. Из 1 кг сахарозы при превращении ее в глюкозу и фруктозу в присутствии воды и фермента сахарозы за 5 часов осталось 0,6 кг. Какое количество сахарозы останется через 2 ч 20 мин? Определите время полураспада.
28. Для реакции H2 + I2 → 2HI при 4440С константа равновесия равна 50. Определите направление процесса, если исходная смесь имеет следующий состав: C(H2) = 2 моль/л, C(HI) = 10 моль/л.
29. Температура кипения раствора, содержащего 6,4 г адреналина в 360 г CCl4 на 0,49 К выше температуры кипения чистого CCl4. Кэ = 5,02 кг∙К/моль. Какова молярная масса адреналина?
30. Этиловый спирт внутривенно иногда вводят при гангрене и абсцессе легкого в виде раствора с массовой долей 20%. Определите, будет ли при 370С этот раствор изотоничен плазме крови? Плотность раствора принять за 1 г/мл.
31. Почему при аллергических реакциях, сопровождающихся отеками тканей, в организм вводят высококонцентрированные растворы хлорида кальция (10%) и глюкозы (20%)?
32. Сколько граммов глюкозы нужно растворить в 270 г воды для повышения температуры на 1 градус?
33. Осмотическое давление раствора гемоглобина в воде, содержащего 124 г в литре при 170С равно 4400 н/м2. Рассчитайте молярную массу гемоглобина.
34. Осмотическое давление плазмы крови равно 780000 н/м2. Рассчитайте, сколько граммов хлорида натрия необходимо для приготовления 200 мл раствора изотоничного плазме крови. Степень диссоциации хлорида натрия равна 95%.
35. Опишите состояние эритроцитов при 310 К в растворах сахарозы с массовой долей 8% (плотность 1,03 г/мл) и глюкозы 2% (1,006 г/мл).
36. Вычислите рН 0,01 моль/л растворов серной кислоты, гидроксида калия, фосфорной кислоты, аммиака, гидроксида цинка, гидрокарбоната натрия, сульфата магния, ацетата аммония.
37. Вычислите степень диссоциации и рН уксусной кислоты, если Ка(СН3СООН) = 1,8·10-5, С(х) = 0,18 моль/л.
38. Определите концентрацию ионов водорода в плазме крови, если рН =7,4.
39. Определите рН буферного раствора, который получен смешиванием 0,1 моль/л раствора NH4Cl и 0,1 моль/л раствора NH4OH в соотношении: а) 1:1; б) 1:4; в) 4:1. KВ(NH4OH) = 1,79·10-5.
40. Вычислите соотношение Ссоли/Скислоты для буферной системы гидрофосфат натрия/дигидрофосфат натрия, если рН = 7,4.
41. Рассчитайте объем 0,2 моль/л раствора гидроксида натрия, который нужно прибавить к 50 мл 0,2 моль/л раствору дигидрофосфата натрия, чтобы получить буферный раствор с рН = 7,4.
42. Вычислите массу ацетата натрия, которую следует добавить к раствору уксусной кислоты С(СН3СООН) = 0,316 моль/л и объемом 2 л, чтобы получить буферный раствор с рН = 4,87.
43. Сколько молей эквивалента аскорбиновой кислоты необходимо ввести больному для нормализации кислотно-основного состояния, если рН его крови 7,5 (норма 7,4) общее количество крови 5 л, емкость по кислоте 0,05 моль/л?
44. На титрование 50 мл воды с эриохромом черным Т было затрачено 4,58 мл раствора комплексона III с молярной концентрацией 0,05114 моль/л. Рассчитайте жесткость воды. Запишите химизм реакций, находящихся в основе количественного определения жесткости воды.
45. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями токсичных металлов (ртуть, мышьяк).
46. Структурными формулами отразите строение активного центра биологических комплексов: хлорофилла, гемоглобина, цианкобаламина, каталазы.
47. Сформулируйте правило константы растворимости (произведения растворимости). Запишите выражения констант растворимости для сульфата кальция и карбоната кальция. Используя справочные данные, сравните их растворимость.
48. В растворе присутствуют в равных концентрациях сульфат- и карбонат-ионы. В каком порядке будут образовываться осадки сульфата и карбоната кальция при постепенном добавлении раствора, содержащего ионы кальция?
49. Сформулируйте условия растворения осадка. Приведите приемы и химические реакции, с помощью которых можно растворить осадок оксалата кальция (СаC2O4).
50. В какой последовательности будут выпадать осадки, если к раствору, содержащему в равных концентрациях ионы Ва2+, Sr2+, Ca2+, Pb2+ постепенно приливать раствор Na2SO4?
51. Используя значения стандартных окислительно-восстановительных потенциалов и учитывая условия направленности процесса, определите, может ли хлор в стандартных условиях окислить: воду до пероксида водорода; бромид-ион до брома; ион железа (II) до иона железа (III); ион марганца (II) до перманганат-иона?
52. Смешали 20 мл раствора хлорида железа (III) с концентрацией 0,05 моль/л и 25 мл раствора хлорида железа (II) с концентрацией 0,02 моль/л. Вычислите величину редокс-потенциала этой системы при Т = 298 К.
53. Рассчитайте массовую долю аскорбиновой кислоты (М(C6H8O6) = 176,13 г/моль) в процентах, если точную массу ее 0,1235 г растворили в воде и оттитровали раствором йода с молярной концентрацией эквивалента 0,098 моль/л. На титрование затрачено 14,0 мл раствора йода.
54. В процессе тканевого дыхания происходит перенос электронов от окисляемого субстрата на кислород с участием переносчиков, непосредственную функцию которых выполняют коферменты: убихинон, ФМН, цитохром с, цитохром b, цитохром аа3, цитохром с1. Исходя из значений окислительно-восстановительных потенциалов (таблица 7 приложения), составьте электронно-транспортную цепь последовательного переноса протонов и электронов от субстрата на акцептор.
55. Укажите, с какой целью используются в медицине следующие вещества и их растворы: Na2SO4·10Н2О, NaCl, NaHCO3, Na2B4O7, KBr, KCl, MgO, MgSO4·7Н2О, CaCl2, CaSO4, BaSO4.
56. Напишите уравнения гидролиза карбоната и гидрокарбоната натрия, укажите рН раствора. Почему нельзя применять раствор карбоната натрия для полоскания горла при воспалении?
57. В хирургической практике применяется раствор пероксида водорода с массовой долей 3%. Сколько миллилитров раствора пероксида водорода с массовой долей 26% (ρ = 1,1 г/мл) необходимо взять для приготовления 500 мл 3% раствора (ρ = 1,05 г/мл)?
58. При некоторых заболеваниях в организм вводят раствор хлорида натрия с массовой долей 0,9%, называемый физиологическим. Вычислите сколько воды и соли нужно взять для приготовления 1 л физиологического раствора, плотность которого 1,005 г/мл.
59. Каким свойством должно обладать вещество, которое используется как противоядие перманганату калия?
60. При 200С осмотическое давление раствора, в 100 мл которого содержится 6,33 г компонента крови гематина (внутрикомплексное соединение железа), равно 243,4 кПа. Определите молярную массу гематина и молекулярную формулу, если известен элементарный состав гематина: С – 64,6%; Н – 5,2%; N – 8,8%; О – 12,6%; Fe – 8,8%.
61. Сульфат цинка применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25 г раствора сульфата цинка с массовой долей 2%, чтобы приготовить глазные капли?
62. Для компенсации недостатка «соляной кислоты» в желудочном соке применяют ее растворы как лекарственные формы. Сколько миллилитров хлороводородной кислоты с массовой долей 24% (ρ = 1,12 г/мл) необходимо для приготовления 200 мл 0,1 моль/л раствора HCl?
63. Сколько таблеток йодида калия необходимо назначать в сутки детям и взрослым, если потребность в йоде для детей составляет 50 мг, а для взрослых 200 мг? Одна таблетка йодида калия имеет массу 130 мг.
Форма проведения контрольной работы:
1. Компьютерное тестирование (10 вопросов).
2. Устное собеседование (билет).
Примерные вопросы тестовых заданий к контрольной работе № 1
Тестовые задания с выбором одного правильного ответа:
1. Массовая доля сахарного раствора (10 г сахара в 190 г воды) равна:
А - 0,01;
Б - 0,05;
В - 0,1;
Г - 0,4.
2. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + 3NaOH =............ равен:
А - 1;
Б - 1/2;
В - 1/3.
3. У больных сахарным диабетом за счет накопления в организме b-гидроксимасляной кислоты может развиваться:
А - метаболический алкалоз;
Б - респираторный алкалоз;
В - метаболический ацидоз;
Г - респираторный ацидоз.
4. Оцените кислотно-основное состояние крови больного на основании следующих показателей: BE = 3 ммоль/л, р(CO2) = 35 мм рт. ст., pH плазмы крови = 7,48.
А - алкалоз;
Б - ацидоз;
В - состояние нормы.
5. Укажите, какие из приведенных смесей электролитов могут проявлять буферные свойства:
а) Na2CO3, NaOH;
б) NH4Cl, NH3·H2O;
в) NaHCO3, CO2  H2O;
H2O;
г) Na2HPO4, NaН2PO4;
д) NaCl, NH2-CH2-COOH.
А - а, б, в, г;
Б - б, в, г;
В - б, в, г, д;
Г - в, г.
6. По какому механизму протекают реакции S 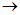 X1
X1 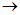 X2
X2 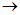 X3
X3 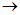 P?
P?
А - последовательному;
Б - параллельному;
В - циклическому;
Г- спиральному.
7. Значение k зависит от:
а) природы реагирующих веществ;
б) температуры;
в) концентрации;
г) катализатора.
А - а, б, в, г;
Б - б, в, г;
В - а, б;
Г - в, г
8. Если Ks(BaSО4) = 1,1∙10-10; Ks(CaCО3) = 3,8∙10-9; Ks(CaSО4) = 3,7 ∙10-5, то растворимость меньше у:
А - BaSО4;
Б - CaCО3;
В - CaSО4.
9. Определите возможность самопроизвольного протекания следующих редокс-процессов в стандартных условиях:
а) 2Fe3+ + 2J-→Fe2+ + J2;
б) 2Fe3+ + 2Br-→Fe2+ + Br2;
φ°(Fe3+/Fe2+) = 0,77В, φ°(J2/2J-) =0,54В, φ°(Br2/2Br-) =1,09В.
А - реакция (а) протекает самопроизвольно, Е°>0, реакция (б) в указанном направлении не протекает, Е°<0;
Б - реакция (а) в указанном направлении не протекает, Е°<0, реакция (б) протекает самопроизвольно, Е°>0;
В - реакция (а) в указанном направлении не протекает, Е°<0, реакция (б) в указанном направлении протекает самопроизвольно, Е°<0;
Г - реакция (а) протекает самопроизвольно, Е°<0, реакция (б) в указанном направлении не протекает самопроизвольно, Е°>0.
10. Для какого элемента характерна следующая биологическая роль: «основной внеклеточный ион, принимающий участие в переносе воды, глюкозы крови, генерации и передаче электрических нервных сигналов, мышечном сокращении? Клинические проявления недостатка иона выражаются как общая слабость, апатия, головные боли, гипотония, мышечные подергивания».
А - натрия;
Б - калия;
В - кальция;
Г - магния.
Не нашли, что искали? Воспользуйтесь поиском: