
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Растворы. Концентрации растворов
Пример 1. В водном растворе хлорида бария объемом 0,800 л с плотностью 1,20  содержится BaCl2 массой 192 г. Вычислите массовую долю и молярную концентрацию.
содержится BaCl2 массой 192 г. Вычислите массовую долю и молярную концентрацию.
Решение. а) Массовая доля (w), выраженная в процентах, показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
 = 0,2 или 20%,
= 0,2 или 20%,
где m – масса ВаСl2;
mp – масса раствора, г (mp = V·ρ = 800·1,2 = 960 г);
V – объем раствора, мл (0,8 л = 800 мл);
ρ – плотность раствора,  .
.
б) Молярная концентрация показывает число молей растворенного вещества в 1 л раствора и выражается в  . Массу ВаСl2 в 1 л раствора находят из соотношения
. Массу ВаСl2 в 1 л раствора находят из соотношения
в 800 мл раствора содержится 192 г ВаСl2
в 1000 мл раствора содержится x г ВаСl2
 = 240 г BaCl2
= 240 г BaCl2
Молярная масса ВаСl2 равна (М(ВаСl2) = 137 + (35,5·2)) = 208 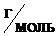 , следовательно, число молей ВаСl2, содержащихся в 1 л раствора, равно
, следовательно, число молей ВаСl2, содержащихся в 1 л раствора, равно
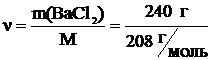 = 1,15 моль.
= 1,15 моль.
Молярная концентрация
 = 1,15
= 1,15  .
.
Пример 2. Какой объем раствора (1) KOH с массовой долей ω1 = 34,9% (ρ1 = 1,34  ) следует взять для приготовления раствора (2) объемом V2 = 250 мл с ω2 = 11,0% (ρ2 = 1,1
) следует взять для приготовления раствора (2) объемом V2 = 250 мл с ω2 = 11,0% (ρ2 = 1,1  ). Чему равна молярная концентрация С2, полученного раствора?
). Чему равна молярная концентрация С2, полученного раствора?
Решение. К решению нужно подойти, исходя из неизменности в исходном и полученном растворах: 1) массы КОН, г; 2) количества КОН, моль. Более рационален второй подход.
Количество КОН

где m – масса КОН;
М – молярная масса КОН.
Учитывая, что m = V2·ρ2·ω2, получаем
 = 0,539 моль.
= 0,539 моль.
Молярная концентрация
 = 2,16
= 2,16 
(обратите внимание на соответствие размерностей величин).
Для исходного раствора
 ,
,
Отсюда объем исходного раствора равен
 = 64,7 мл.
= 64,7 мл.
Задания
103. Вычислите молярную концентрацию раствора хлорида натрия (ρ = 1,148  ) с массовой долей NaCl – 20%.
) с массовой долей NaCl – 20%.
104. Какой объем раствора хлороводородной кислоты (ρ = 1,100  ) с массовой долей НСl 20,01% требуется для приготовления 1 л раствора (ρ = 1,050
) с массовой долей НСl 20,01% требуется для приготовления 1 л раствора (ρ = 1,050  ) с массовой долей 10,17%?
) с массовой долей 10,17%?
105. Смешали 10 мл раствора азотной кислоты (ρ = 1,056  ) с массовой долей HNO3 10% и 100 мл раствора той же кислоты (ρ = 1,184
) с массовой долей HNO3 10% и 100 мл раствора той же кислоты (ρ = 1,184  ) с массовой долей (%) HNO3 в полученном растворе.
) с массовой долей (%) HNO3 в полученном растворе.
106-110. Водный раствор содержит массу m вещества А в объеме V. Плотность раствора ρ. Вычислите массовую долю (в %), молярную долю, молярную концентрацию, молярную концентрацию эквивалентов.
| Номер задачи | A | m, г | V, л | ρ, 
|
| H2SO4 | 1,0 | 1,44 | ||
| Н3РO4 | 2,5 | 1,15 | ||
| KOH | 2,0 | 1,27 | ||
| HNO3 | 3,0 | 1,21 | ||
| НСl | 0,5 | 1,10 |
111-115. Какой объем раствора вещества A с массовой долей ω1, (плотность ρ1) следует взять для приготовления объема V2 раствора с массовой долей ω2 (плотность ρ2)? Чему равна молярная концентрация полученного раствора?
| Номер задачи | А | ω1, % | ρ1, 
| V2, л | ω2, % | ρ2, 
|
| HNO3 | 27,0 | 1,160 | 1,00 | 20,0 | 1,115 | |
| Na2CO3 | 15,2 | 1,160 | 2,50 | 4,50 | 1,045 | |
| NH3 | 26,0 | 0,904 | 2,00 | 5,25 | 0,976 | |
| NaOH | 40,0 | 1,430 | 5,00 | 10,00 | 1,110 | |
| H2S04 | 95,1 | 1,834 | 10,00 | 4,00 | 1,025 |
116-120. К раствору вещества А объемом Vl с молярной концентрацией c1 добавили воду объемом  . Плотность полученного раствора ρ2. Чему равны молярная концентрация полученного раствора c2 и массовая доля ω2?
. Плотность полученного раствора ρ2. Чему равны молярная концентрация полученного раствора c2 и массовая доля ω2?
Не нашли, что искали? Воспользуйтесь поиском: