
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электродные потенциалы. Гальванические элементы
Пример 1. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого:
Ni │ NiSO4 ║ CoSO4 │ Co
(0,001 M) (1 M)
(В скобках приведены молярные концентрации растворов соответствующих солей). Вычислите величину электродвижущей силы (ЭДС) гальванического элемента.
Решение. Рассчитаем величины электродных потенциалов по уравнению Нернста:
 ,
,
где  – стандартный электродный потенциал (см. в Приложении: табл. 6;
– стандартный электродный потенциал (см. в Приложении: табл. 6;  = –0,25 В;
= –0,25 В;  = –0,28 В).
= –0,28 В).
 = –0,25 +
= –0,25 +  ·(–3) = –0,34 В.
·(–3) = –0,34 В.
 = –0,28 +
= –0,28 +  ·0 = –0,28 В.
·0 = –0,28 В.
На электроде, имеющем меньший потенциал, происходит отдача электронов, т. е. окисление. Этот электрод называется анодом. Поскольку  <
<  , анодом является никелевый электрод.
, анодом является никелевый электрод.
На электроде, имеющем больший потенциал, происходит принятие электронов, т. е. восстановление. Этот электрод называется катодом. Им является кобальтовый электрод.
Процессы, протекающие в гальваническом элементе:
Анод Ni – 2  = Ni2+
= Ni2+
Катод Co2+ + 2  = Co
= Co
Ионно-молекулярное уравнение: Ni + Co2+ = Ni2+ + Co
Молекулярное уравнение: Ni + CoSO4 = NiSO4 + Co
ЭДС = E(к) – E(а) = –0,28 – (–0,34) = 0,06 В.
Пример 2. В каком направлении может самопроизвольно протекать реакция
2Bi + 3CdCl2  2BiCl3 + 3Cd
2BiCl3 + 3Cd
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1  .
.
Решение. Окислительно-восстановительная реакция возможна, если потенциал предполагаемого окислителя больше потенциала предполагаемого восстановителя: Eокисл > Eвосст. Для прямой реакции



окислителем должен являться ион Cd2+, а восстановителем – металлический висмут  . Однако соотношение их электродных потенциалов:
. Однако соотношение их электродных потенциалов: 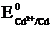 = –0,40 В <
= –0,40 В <  = +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
= +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
Для обратной реакции окислителем оказывается ион Bi3+, а восстановителем – металлический кадмий  , т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
, т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
2BiCl3 + 3Cd = 2Bi + 3CdCl2
В гальваническом элементе на аноде (Cd) протекает процесс окисления кадмия, а на катоде (Bi) – процесс восстановления ионов Bi3+:
Анод Cd – 2  = Cd2+ │ 3
= Cd2+ │ 3
Катод Bi3+ + 3  = Bi │ 2
= Bi │ 2
2Bi3+ + 3Cd = 2Bi + 3Cd2+
Схема гальванического элемента:
(А) Cd │ CdCl2 ║ BiCl3 │ Bi (К)
ЭДС = E(к) – E(а) =  –
– 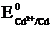 = +0,22 – (–0,40) = 0,62 В.
= +0,22 – (–0,40) = 0,62 В.
Задания
141-150. Напишите уравнения анодного и катодного процессов, Суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе. Вычислите величину электродвижущей силы (ЭДС) гальванического элемента при указанных молярных концентрациях растворов соответствующих солей.
| Номер задачи | Схема гальванического элемента |
| Cu | CuSO4 || AgNO3 | Ag (1 M) (0,1 M) | |
| Bi | Bi(NO3)3 || Cu(NO3)2 | Cu (0,001 M) (1 M) | |
| Fe | FeSO4 || CdSO4 | Cd (0,001 M) (1 M) | |
| Ni | NiSO4 || CuSO4 | Cu (1 M) (0,01 M) | |
| Cd | CdSO4 || NiSO4 | Ni (0,01 M) (1 M) | |
| Zn | ZnSO4 || AgNO3 | Ag (1 M) (0,01 M) | |
| Cd | CdSO4 || CdSO4 | Cd (0,01 M) (1 M) | |
| Co | CoSO4 || CuSO4 | Cu (1 M) (0,01 M) | |
| Ni | NiSO4 || Bi(NO3)3 | Bi (0,1 M) (1 M) | |
| Pb | Pb(NO3)2 || AgNO3 | Ag (1 M) (0,01 M) |
151-160. Дайте обоснованный ответ, в каком направлении может самопроизвольно протекать заданная реакция? Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1  .
.
| Номер задачи | Схема реакции |
Cu + HgCl2  CuCl2 + Hg CuCl2 + Hg
| |
Cu + NiCl2  CuCl2 + Ni CuCl2 + Ni
| |
Pb + Co(NO3)2  Pb(NO3)2 + Co Pb(NO3)2 + Co
| |
| Номер задачи | Схема реакции |
Zn + NiSO4  ZnSO4 + Ni ZnSO4 + Ni
| |
Cu(NO3)2 + 2Ag  2AgNO3 + Cu 2AgNO3 + Cu
| |
CuSO4 + Co  CoSO4 + Cu CoSO4 + Cu
| |
2Bi + 3Ni(NO3)2  2Bi(NO3)3 + 3Ni 2Bi(NO3)3 + 3Ni
| |
2Ag + Co(NO3)2  2AgNO3 + Co 2AgNO3 + Co
| |
Bi + 3AgNO3  Bi(NO3)3 + 3Ag Bi(NO3)3 + 3Ag
| |
HgCl2 + Ni  Hg + NiCl2 Hg + NiCl2
|
Электролиз
Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с висмутовыми электродами.
Для каждого варианта вычислите массы веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10,0 А в течение 1 ч 10 мин. Для газообразных веществ определите их объем при н.у.
Решение. а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся бόльшим потенциалом. К отрицательно заряженному катоду движется катионы Bi3+, которые могут восстанавливаться до металлического висмута ( + 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода (
+ 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода ( = 0,00 В при pH 0;
= 0,00 В при pH 0;  = –0,41 В при pH 7). Поскольку
= –0,41 В при pH 7). Поскольку  >
>  , то на катоде восстанавливается висмут:
, то на катоде восстанавливается висмут:
Bi3+ + 3  = Bi
= Bi
К положительно заряженному аноду движутся анионы  и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
2H2O – 4  = O2 + 4H+
= O2 + 4H+
По законам Фарадея масса восстановленного на катоде висмута:
 , (1)
, (1)
где  ;
;
I – сила тока, А;
τ – продолжительность электролиза, с;
F – константа Фарадея, 96 500 Кл.
 = 30,3 г.
= 30,3 г.
Масса выделившегося на аноде кислорода:
 = 3,48 г,
= 3,48 г,
где  .
.
Объем, занимаемый газом при н.у., определяется по формуле:
 ,
,
где n – количество газа, моль;
m – масса газа, г;
M – молярная масса газа, 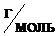 ;
;
V0 = 22,4 л – объем одного моль газа при н.у.
Для кислорода
 = 2,44 л.
= 2,44 л.
б) На висмутовом аноде кроме окисления воды возможно окисление висмута – материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку  = +0,22В <
= +0,22В <  = +1,23В, то окисляться будет материал анода:
= +1,23В, то окисляться будет материал анода:
Bi – 3  = Bi3+
= Bi3+
На катоде, как и в варианте (а), восстанавливается висмут:
Bi3+ + 3  = Bi
= Bi
Массы осажденного на катоде и растворенного на аноде висмута одинаковы и определяются уравнением (1): на катоде из раствора восстановилось 30,3 г висмута и столько же висмута растворилось на аноде.
Пример 2. При электролизе водных растворов AgNO3 и NiSO4 в двух электролизерах, соединенных последовательно, на катодах выделилось соответственно серебро массой 5,39 г и никель массой 1,39 г. Определите выход по току никеля, если выход по току серебра 100%. Какова продолжительность электролиза при силе тока 5,00 А?
Решение. Если на электроде возможно одновременно протекание нескольких процессов, то используют понятие выхода по току. Выходом по току i-го вещества (Bi) называется доля общего количества электричества в процентах, которая расходуется на окисление или восстановление i-го вещества при электролизе
 ,
,
где Q = I·τ – общее количество прошедшего электричества;
Qi – количество электричества, израсходованное на окисление или восстановление i-го вещества;
mi – масса i-го вещества, окисленного или восстановленного на электроде;
mi(τ) – то же, теоретически рассчитанное из предположения 100%-ного выхода по току.
Из законов Фарадея по массе выделившегося серебра при 100%-ном выходе по току определим продолжительность электролиза τ:
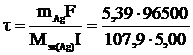 = 964 с = 16 мин 4 с.
= 964 с = 16 мин 4 с.
Рассчитаем массу никеля, которая выделилась бы при 100%-ном выходе по току
 = 1,47 г.
= 1,47 г.
Выход по току никеля
 = 94,6%.
= 94,6%.
Пример 3. В течение какого времени следует проводить электролиз при силе тока 8,00А для выделения на катоде всей меди, содержащейся в 250 мл 0,100 М раствора CuSO4?
Решение. Из законов Фарадея
 ,
,
или
 , (2)
, (2)
где nэк(Cu) – количество моль эквивалентов меди.
Количество моль меди в растворе
nCu = cV = 0,100·0,250 = 0,0250 моль,
где c – молярная концентрация CuSO4,  ;
;
V – объем раствора, л.
Поскольку эквивалент меди ЭCu = ½ Cu, то nэк(Cu) = 2nCu =
= 2·0,0250 = 0,0500 моль. Подставим значение nэк(Cu) в уравнение (2):
 = 603 c = 10 мин 3 с.
= 603 c = 10 мин 3 с.
Задания
161-168. Электролиз водного раствора вещества X проводили с угольными электродами катодного и анодного процессов. Вычислите массы веществ, выделившихся на катоде и на аноде. Определите объем выделившихся газообразных веществ (н.у.).
| Номер задачи | X | I, A | τ |
| CuSO4 | 15,0 | 5 ч 37 мин | |
| K2SO4 | 10,0 | 30 мин | |
| NaOH | 25,0 | 30 мин | |
| AgNO3 | 10,1 | 1 ч 40 мин | |
| KI | 10,0 | 50 мин | |
| NaBr | 18,0 | 1 ч 40 мин | |
| Al2(SO4)3 | 20,0 | 45 мин | |
| H2SO4 | 15,0 | 25 мин |
169-175. Электролиз водного раствора вещества X проводили с анодом из материала Y при силе тока I. Составьте уравнения электродных процессов. Определите, сколько потребуется времени для окисления на аноде массы mA соответствующего вещества. Составьте уравнения электродных процессов с угольным анодом.
| Номер задачи | X | Y | mA, г | I, A |
| NiSO4 | Ag | 15,0 | 10,0 | |
| AgNO | Ag | 100,0 | 20,0 | |
| SnCl2 | Sn | 45,0 | 15,0 | |
| Na2SO4 | Cd | 50,0 | 25,0 | |
| Номер Задачи | X | Y | mA, г | I, A |
| MgCl2 | Mg | 15,0 | 15,0 | |
| H2SO4 | Cu | 65,0 | 30,0 | |
| CdSO4 | Cd | 60,0 | 10,0 |
176. При электролизе водных растворов KI и CuSO4 в двух электролизерах, соединенных последовательно, масса одного из катодов увеличилась на 15,7 г. Какое количество электричества было пропущено через электролизеры? Составьте уравнения катодных и анодных процессов в каждом из электролизеров, если электроды угольные.
177. Через два соединенных последовательно электролизера, содержащих, соответственно, водные растворы Na2SO4 и AgNO3, пропускали ток силой 10,0 А в течение 1 ч 40 мин. На какую величину увеличилась масса одного из электродов? Составьте уравнения всех катодных и анодных процессов, если электроды угольные.
178. Составьте уравнения процессов, протекающих на угольных электродах при электролизе: а) водного раствора MgCl2; б) расплава MgCl2. Вычислите массу веществ, выделяющихся на электродах в том и другом случаях, если через раствор и расплав пропустили ток силой 20,0 А в течение 1 ч 20 мин. Определите объем выделяющихся газов (н.у.).
179. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время
180. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоды выделилось 1,4 л водорода (н.у.).
Не нашли, что искали? Воспользуйтесь поиском: