
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химическая термодинамика 1 страница
Химические реакции сопровождаются энергетическими эффектами, т.е. происходит выделение или поглощение энергии. Изучением энергетики химических реакций занимается химическая термодинамика. В химической термодинамике для характеристики энергетического состояния системы используются: внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G и другие термодинамические потенциалы. Внутренняя энергия U – это общий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, энергии движения и взаимодействия ядер и электронов в атомах (т.е. все виды энергии кроме кинетической энергии системы как целого и ее потенциальной энергии положения). В изохорном процессе (V = const) энергетический эффект реакции равен изменению внутренней энергии системы DU, а в случае изобарного процесса – изменению энтальпии DН, которую можно рассчитать по формуле DН = DU + рDV.
Для расчета DН химической реакции используют закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от промежуточных стадий процесса.
Изменение энтальпии химической реакции (тепловой эффект реакции) можно рассчитать по разности сумм стандартных значений начальных и конечных продуктов реакции:
DНх.р. = å DНо обр. продуктов - å DНообр. исходных веществ
где: DНообр. − стандартное значение энтальпии образования одного моля соединения из простых веществ, измеренное при Т = 298 К, Р = 101,3 кПа.
Энтропия S – функция состояния системы, изменение которой характеризует процессы перехода теплоты в обратимых изотермических процессах. Энтропия является мерой беспорядка в системе. При переходе системы из более упорядоченного состояния в менее упорядоченное состояние энтропия возрастает: DS = (S2 – S1)> 0. Самопроизвольные процессы связаны с ростом энтропии. Для химических реакций энтропию можно рассчитать как разность сумм энтропий конечных и начальных продуктов реакции:
DSх.р. = å Sопродуктов - å Sо исходных веществ,
где Sо – стандартное значение энтропии.
Энтальпия и энтропия связаны друг с другом уравнением Гиббса:
DG = DH - TDS,
где DG – изобарно-изотермический потенциал или энергия Гиббса.
DG характеризует направленность процесса при Р,Т= const. Если изменение DG > 0, то процесс не идет самопроизвольно в данных условиях.
В случае DG=0 система находится в состоянии равновесия. Следовательно, DН = ТDS и равновесная температура Травн = DS / DН.
Если DG< 0, равновесие в системе смещено вправо, реакция возможна. Изобарно-изотермический потенциал DG является функцией состояния системы, поэтому изменение DG зависит от начального и конечного состояния веществ и рассчитывается по разности сумм стандартных значений DGообр. начальных и конечных продуктов реакции при постоянной температуре (Т= const):
DGх.р. = å DGо обр. продуктов - å D Gообр. исходных веществ
DGо обр. − стандартное значение энергии Гиббса, измеренное при Т=298 К, Р= 101,3 кПа для 1 моля вещества. DGо обр. приводится в таблицах и измеряется в кДж/моль. DGо обр.простых веществ равно нулю.
7.2. Задачи для самостоятельного решения
1. Вычислите, сколько выделится теплоты при сгорании серы массой 12 г, если термохимическое уравнение реакции горения серы имеет вид: S(к) + О2(г) = SO2(г) + 296,9 кДж?
2. Реакция протекает по уравнению: C6H6(ж) + HNO3(ж) = C6H5NO2(ж) + H2О(г). Определите, возможно ли ее самопроизвольное протекание при стандартных условиях.
3. Рассчитайте количество теплоты, выделившееся при образовании аммиака объёмом 448 л (н.у.), если протекает реакция: 3Н2(г)+N2(г) = 2NH3(г) + 92 кДж.
4. Что будет являться при стандартных условиях более сильным окислителем: Cl2 или I2? Ответ дайте на основании значения ΔG прямой реакции: 2HCl(г) + I2(к) = 2HI(г) + Cl2(г).
5. При какой температуре наступает равновесие системы СО(г) + 2Н2(г) ↔ СН3ОН(ж)?
6. Реакция горения этана выражается термохимическим уравнением:
С2Н6(г) + 7/2О2 = 2СО2(г) + 3Н2О(ж); ΔН = -1559,87 кДж/моль. Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж).
7. Исходя из теплоты образования газообразного диоксида углерода
(ΔНº298 = -393,5 кДж/моль) и термохимического уравнения С(графит) + 2N2O(г) = СО2(г) + 2N2(г); ΔH = -557,5 кДж/моль, вычислите теплоту образования N2O(г).
8. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите ΔGº298 реакции, протекающей по уравнению СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж). Возможна ли эта реакция при стандартных условиях?
9. Рассчитав ΔG, укажите, какая из двух реакций будет протекать самопроизвольно:Fе (к) + А12О3 (к) = А1(к) + Fе2О3 (к); А1(к) + Fе2О3 (к) = Fе (к) + А12О3 (к)?
10. Вычислите ΔН, ΔS и ΔG реакции, протекающей по уравнению: ТiO2(к) + 2С(к) = Тi(к) + 2СО(г). Возможна ли реакция восстановления ТiO2 углеродом при температурах 1000 и 3000К?
7.3. Лабораторная работа: Определение теплоты реакции нейтрализации
Цель: Приобрести навыки калориметрического определения теплоты химической реакции.
Сущность работы: Изучается выделение теплоты при реакции нейтрализации по повышению температуры раствора. Согласно теории электролитической диссоциации реакция нейтрализации отвечает уравнению: H+ + OH− = H2O
Теплота нейтрализации сильной кислоты сильным основанием равна -55,9 кДж/моль.
Выполнение работы:
Подготовить для работы калориметр.
Записать исходные данные:
- масса внутреннего стакана калориметра m, г ____,
- объемы растворов реагирующих веществ V, мл ____,
- концентрация растворов c, моль/л ____,
- удельная теплоемкость раствора (воды) c(H2O) – 4,184 Дж/(г∙К),
- удельная теплоемкость стекла с (ст) – 0,753 Дж/(г∙К).
3. Измерить температуру исходных растворов кислоты и щелочи
Ткислоты -
Тщелочи -
Т1 = (Ткислоты + Тщелочи)/2
К раствору щелочи, объемом 100 мл, через воронку быстро влить равный объем кислоты, перемешать в течение нескольких секунд, записать самое высокое показание термометра. Т2 -
Обработка результатов:
Рассчитать общую теплоемкость калориметра:
Cm = Cm(H2O)∙m(раствор) + Cm(ст)∙m(стакан), где m(раствор) – масса раствора в колориметре, вычисляемая по объему взятых растворов и их плотности. Плотность может быть принята равной 1 г/мл.
Вычислить выделившуюся в калориметре теплоту:
Q = CmΔТ, где ΔТ = Т2 – Т1
ΔН = - Q
Рассчитать стандартную теплоту реакции нейтрализации:
ΔН0 = ΔН/n
Где n – количество одного из веществ, участвующих в реакции.
Найти отклонение найденного значения от расчетного.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
К окислительно-восстановительным реакциям (ОВР) относятся такие химические процессы, которые связаны с переходом электронов от одного атома к другому и изменением степеней окисления этих атомов.
Окисление − процесс отдачи электронов. Атом, отдающий электроны, окисляется и является восстановителем по отношению к атому, принимающему эти электроны. При окислении атома его степень окисления повышается, например:
 S-2 – 2e = S0 S-2 теряет электроны, окисляется,
S-2 – 2e = S0 S-2 теряет электроны, окисляется,
S-2 – 4e = S+2 является восстановителем. Степень
S-2 – 6e = S+4 окисления ее повышается с –2 до 0,
S-2 – 8e = S+6 +2, +4 или +6, соответственно.
Восстановление − процесс приема электронов. Атом, принимающий электроны, восстанавливается и является окислителем. В процессе восстановления степень окисления атома понижается, например:
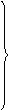 S+6 + 2e = S+4 S+6 принимает электроны, восстанавливается,
S+6 + 2e = S+4 S+6 принимает электроны, восстанавливается,
S+6 + 4e = S+2 является окислителем. Степень окисления ее
S+6 + 6e = S0 понижается с +6 до +4, +2, 0 или –2,
S+6 + 8e = S-2 соответственно.
Окисление-восстановление − это взаимосвязанный процесс. Окисление одного атома всегда сопровождается восстановлением другого, и наоборот.
Степень окисления атома − это условный заряд атома в соединении, вычисленный исходя из предположения, что молекула состоит только из ионов.
Для составления уравнений окислительно-восстановительных реакций необходимо определить величину и знак степени окисления атомов в молекуле, руководствуясь следующими положениями:
1. В простых веществах степень окисления атомов равна нулю, например: С12О, Н2О, N2О, Fe0, Zn0, S0 и т.д.
2. В сложных веществах ряд атомов проявляет постоянную степень окисления:
− степень окисления +1 характерна в соединениях для атомов щелочных металлов (Li+1, Na+1, К+1, Rb+1,Cs+1, Fr+1) и водорода, связанного с атомом неметалла (Н+1С1-1, Н2+1О-2);
− степень окисления +2 характерна для атомов s-элементов II группы (Ве+2, Mg+2, Са+2, Sr+2, Ва+2, Ra+2); степень окисления +3 характерна для атомов алюминия (Аl+3);
− степень окисления -1 проявляют всегда в соединениях атомы фтора (F-1), а также атомы водорода в гидридах (Na+1Н-1, Са+2Н2-1);
− степень окисления -2 имеет кислород, за исключением фторида кислорода и перекисей. По величине электроотрицательности кислород уступает только фтору, поэтому в соединении с этим элементом (OF2) его степень окисления положительна (+2). В перекиси водорода (Н+1−О-1−О-1−Н+1) и ее производных за счет неполярности связи между атомами кислорода на каждый из них приходится степень окисления –1.
3. Большинство остальных атомов способны проявлять переменную степень окисления. Для ее нахождения необходимо помнить:
− сумма степеней окисления всех атомов в молекуле равна нулю;
− сумма степеней окисления всех атомов в ионе равна заряду этого иона.
8.3.
Окислительные свойства железа (III)
Для выявления окислительных свойств производных железа (III) в кислой среде провести соответствующие реакции, взяв в качестве восстановителей растворы иодида калия и сульфита натрия. Для этого в две пробирки внести по 3-5 капель хлорида железа (III), добавить по 3 капли раствора соляной кислоты. Отметить цвет. В одну пробирку внести 3-5 капель раствора иодида калия, в другую – такое же количество раствора сульфита натрия (можно использовать сухую соль). Объяснить происходящие изменения. Написать уравнения реакций, обосновать коэффициенты.
Опыт 3. Восстановительные свойства соединений железа (II)
В две пробирки внести по 3-5 капель раствора сульфата железа (II), подкислить 2-3 каплями разбавленной серной кислоты, в одну пробирку прилить 3-5 капель раствора KMnO4, в другую – такое же количество раствора K2Cr2O7. Отметить изменение окраски. Составить уравнения реакций, обосновать коэффициенты.
. Окислительные свойства соединений хрома (VI)
К раствору бихромата калия, подкисленному разбавленной серной кислотой, добавить сухую соль NaNO2 или Na2SO3. Отметить изменение окраски. Составить уравнения реакции, обосновать коэффициенты.
Опыт 3. Влияние среды на окислительные свойства перманганат-иона MnO4-
В три пробирки поместить по 5 капель разбавленного раствора KMnO4. Для создания различной среды добавить в одну пробирку разбавленную серную кислоту, в другую - воду, в третью - концентрированный раствор щелочи (по 3-4 капли). Отметить окраску растворов. В каждую из пробирок добавить сульфит натрия (1 микрошпатель сухой соли). Объяснить происходящие изменения. Составить уравнения окислительно-восстановительных реакций, обосновать коэффициенты.
8.2. Задачи для самостоятельного решения
Уравняйте окислительно-восстановительные реакции методом электронного баланса, укажите окислитель и восстановитель. Определите тип окислительно-восстановительной реакции:
1. MnSO4 + РbО2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O;
2. HgS + HNO3 + HC1 → HgCl2 + S + NO + H2O;
3. Zn + KNO3 + KOH → K2ZnO2 + NH3 + H2O;
4. I2 + H2O + C12 → HIO3 + HC1.
5. KMnO4 + NH3 → KNO3 + MnO2 + KOH + H2O.
6. СоВr2 +О2 + КОН + Н2О → Со(ОН)3 + КВr.
7. SbCl3 + HgCl + NaOH → NaSbO3 + NaCl + Hg + H2O;
8. H2O2 + K2Cr2O7 + H2SO4 → O2 + Cr2(SO4)3 + K2SO4 + H2O;
9. KMnO4 + NaNO2 + Ва(ОН)2 → BaMnO4 + NaNO3 + KOH + Н2О;
10. Co(NO3)2 → Со2О3 + NO2 + О2;
4. Растворы электролитов. Электролитическая диссоциация
Электролиты - вещества, проводящие электрический ток в расплавленном и растворенном состоянии. В среде высокой диэлектрической проницаемости (спирты, вода и др.) они распадаются на ионы. Процесс распада молекул на ионы называется электролитической диссоциацией.
Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин сольватация заменяется термином гидратация.
Электролитическая диссоциация – процесс обратимый, и в растворах электролитов существует равновесие между ионами и молекулами.
Степень диссоциации (a) показывает отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры. Для одного и того же электролита при данной температуре a увеличивается с разбавлением раствора; при больших разбавлениях электролит полностью диссоциирует (a®1). С увеличением температуры a также увеличивается.
По степени диссоциации электролиты делятся на сильные, средние и слабые. К сильным электролитам относятся такие, которые в 0,1 М растворе имеют a>30%. Сильными электролитами являются: 1) почти все соли (кроме HgCl2, СdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторые другие); 2) многие минеральные кислоты, например HNO3, HCl, H2SO4, HI, HBr, HСlO4 и др.;
3) основания щелочных и щелочно-земельных металлов, например KOH, NaOH, Ba(OH)2 и др.
У средних электролитов a = 3 - 30 % в 0,1 М растворах; к ним относятся, например, H3PO4, H2SO3, HF, Mg(OH)2.
Для слабых электролитов в 0,1 М растворах a < 3 %; слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и др., а также большинство оснований многовалентных металлов, NH4OH и вода.
Об относительной силе электролитов можно судить по электрической проводимости их растворов.
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH-:
NaOH ® Na+ + OH-;
Ca(OH)2 ® CaOH+ + OH-;
CaOH+ ® Ca2+ + OH-.
Ступенчатость диссоциации обусловливает возможность образования основных и кислых солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H+.
HCl ® H+ + Cl-;
H2SO4 ® H+ + HSO4-;
HSO4- ® H+ + SO42-.
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H+ и гидроксид-анионы OH-:
H+ + MeO- ⇄ MeOH ⇄ Me+ + OH-.
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
Например, диссоциация Zn(OH)2:
2 H+ + ZnO22- ⇄ H2ZnO2 ⇄ Zn(OH)2 ⇄ Zn2+ + 2 OH-.
Диссоциация солей
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Например,
Na2SO4 ® 2 Na+ + SO42-.
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка:
KHSO3 ® K+ + HSO3- (a = 1).
Сложный анион диссоциирует частично:
HSO3- ⇄ H+ + SO32- (a << 1).
3.Основные соли при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксо-групп OH-:
Al(OH)2Cl ® Al(OH)2+ + Cl- (a = 1).
Сложный катион диссоциирует частично:
Al(OH)2+ ⇄ AlOH2+ + OH- (a << 1);
AlOH2+ ⇄ Al3+ + OH- (a << 1).
4.В результате диссоциации водный раствор двойной соли содержит два катиона и анион кислотного остатка:
KAl(SO4)2 ® K+ + Al3+ + 2 SO42-;
Na2NH4PO4 ® 2 Na+ + NH4+ + PO43-.
5.Сложные соли диссоциируют на катион металла и анионы кислотных остатков:
ZnClNO3 ® Zn2+ + Cl- + NO3-;
AlSO4Cl ® Al3+ + SO42- + Cl-.
Константа диссоциации. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать константу равновесия:
AmBn ⇄ m An+ + n Bm-
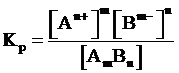 .
.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации.
Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Если общая концентрация электролита, например, слабой кислоты типа HA равна С моль/л, тогда концентрация ионов H+ и A- будет определяться выражением Сa (моль/л), [H+] = [A-], а концентрация недиссоциированного электролита (С-Сa). Тогда
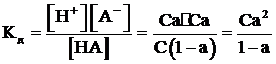 .
.
При a << 1 получим Кд = С.a2. Откуда

Смещение ионного равновесия, которое приводит к увеличению или уменьшению степени диссоциации слабого электролита, осуществляется по принципу Ле Шателье. Введение в раствор одноименного иона, т.е. увеличение концентрации одного из продуктов реакции, приводит к смещению ионного равновесия влево, в сторону образования молекул или к уменьшению степени диссоциации электролита. Наоборот, связывание одного из ионов в малодиссоциированное вещество ведёт к повышению степени диссоциации электролита.
Активность ионов. В растворах сильные электролиты распадаются на ионы практически полностью, поэтому концентрация ионов довольно велика. Между ионами действуют силы взаимодействия, даже при небольшой концентрации электролита. Ионы не являются свободными при движении, и свойства электролита, зависящие от числа ионов, проявляются слабее, чем если бы ионы не взаимодействовали между собой. В связи с этим состояние ионов описывают активностью – условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах.
Активность иона а (моль/л) связана с его молярной концентрацией в растворе См соотношением
а = f См,
где f - коэффициент активности иона (безразмерная величина). Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона и других условий.
В разбавленных растворах при См << 0,5 моль/л природа иона слабо влияет на значение f. Приближенно считают, что в разбавленных растворах f иона в данном растворителе зависит только от заряда иона и ионной силы раствора Ι, которая равна полусумме произведений концентрации См каждого иона на квадрат его заряда Z:
n
Ι = 0,5 (C1Z12 + C2Z22 + … + CnZn2) = 0,5 Σ Ci Zi 2.
i=1
Например, для 2 М раствора электролита CaCl2 = Ca2+ + Cl- ионная сила раствора равна
I = 0,5 (2. 22 + 2. 12) = 5.
Значения коэффициентов активности ионов в разбавленных растворах в зависимости от их заряда и ионной силы раствора приведены в приложении 1.
Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) ZnОН+ + OН- = Zn(ОН)2;
б) Рb2+ + СrO42- = PbCrO4;
в) Н++ ОН- = Н2О.
а) СО32- + 2H+ = СO2 ↑ + H2O;
б) Н2PO4‾ +2OH‾ = PO43‾ + 2H2O;
в) ОH- + NH4+ = NH4OH.
а) Н3BO3 + OH- = H2BO3- + H2O;
б) 2РO43-+ 3Са2+ = Са3(РО4)2;
в) 2Н+ + 2NO2- = NO↑+ NO2↑+ H2O.
а) SiО32- + 2Н+ = Н2SiO3;
б) Сr(ОН)2+ + ОH- = Сr(ОН)3;
в) 2Аg+ + 2ОH- = Аg2O + Н2O.
205. Напишите молекулярные и ионные уравнения реакций между растворами:
а) серной кислоты и хлорида бария;
б) гидроксида калия и фосфорной кислоты;
в) карбоната натрия и нитрата свинца (II).
а) соляной кислоты и нитрата серебра;
б) хлорида бария и сульфата меди (II);
в) гидроксида кальция и азотной кислоты.
а) карбоната натрия и хлорида кальция;
б) гидроксида бария и соляной кислоты;
в) серной кислоты и нитрата бария.
а) карбоната натрия и серной кислоты;
б) нитрата меди (II) и гидроксида натрия;
в) нитратом серебра и хлоридом железа (III).
а) хлорида железа (III) и гидроксида калия;
б) нитрата бария и карбоната натрия;
в) сульфата алюминия и хлорида бария.
210. См. условие задачи 205.
а) ортофосфата калия и сульфата алюминия;
б) соляной кислоты и сульфида натрия;
в) карбоната калия и ортофосфорной кислоты.
211. См. условие задачи 205.
а) сульфитом натрия и серной кислотой;
б) нитрата свинца (II) и иодида калия;
в) хлоридом аммония и гидроксидом кальция.
212. См. условие задачи 205.
а) сульфида натрия и сульфата железа (II);
б) серной кислоты и гидроксида лития;
в) нитрата кальция и карбоната калия.
213. См. условие задачи 205.
а) азотной кислоты и гидроксида бария;
б) карбоната калия и соляной кислоты;
в) нитрата свинца (II) и сульфата калия.
214. См. условие задачи 205.
а) нитрата бария и сульфата натрия;
б) гидроксида калия и нитрата железа (II);
в) карбоната натрия и серной кислоты.
Лабораторная работа: Электролитическая диссоциация
Цель работы: Изучение электрической проводимости растворов электролитов и зависимости её от различных факторов, умение предсказывать направление обменной реакции в растворах электролитов.
Оборудование и реактивы: Прибор для испытания электрической проводимости растворов. Бюретка (50 мл). Промывалка. Пробирки конические. Стандартный штатив с реактивами. Ацетат натрия (крист.). Хлорид аммония. Индикаторы: фенолфталеин, метилоранж. Растворы: уксусной кислоты (0,1 М; 70 %-ный), аммиака (0,1 М; 25 %-ный), гидроксида натрия (0,1 М; 40 %-ный), азотной кислоты (0,1 М), соляной кислоты (0,1 М), гидроксида калия (0,1 М), серной кислоты (0,02 М), гидроксида бария (0,02 М), сульфата алюминия (0,1 М).
Опыт 1. Изучение электрической проводимости растворов
После каждого испытания выключать прибор из электрической сети и промывать электроды дистиллированной водой!
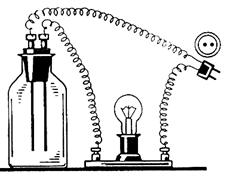
Рис.1. Прибор для испытания электрической проводимости растворов
А. В прибор для испытания электрической проводимости растворов (рис.1) налить дистиллированной воды, опустить предварительно промытые дистиллированной водой угольные электроды, включить вилку прибора в электрическую сеть. Отметить визуально степень накала лампы.
Б. Исследовать электрическую проводимость (см. опыт 1.А.) каждого из шести 0,1 М растворов: CH3COOH, NH4OH, HNO3, HCl, NaOH, KOH.
Записать результаты наблюдений, отмечая степень накала лампы. По степени накала лампы сделать вывод: сильным или слабым электролитом является тот или иной раствор.
В. Смешать равные объемы растворов: 1) сильной кислоты и сильного основания; 2) слабой кислоты и слабого основания. Испытать электрическую проводимость полученных растворов (см. опыт 1.А). Записать наблюдения и составить уравнения реакций в молекулярной и ионной формах. Сделать вывод об электрической проводимости полученных растворов.
Опыт 2. Зависимость электрической проводимости раствора (степени диссоциации электролита) от разбавления
В прибор (см. опыт 1.А) налить минимальный объём концентрированного раствора уксусной кислоты, необходимый для погружения электродов, включить прибор в электрическую сеть и отметить степень накала лампы. Затем кислоту разбавить, добавляя постепенно дистиллированную воду. Как меняется степень накала лампы? Чем объяснить наблюдаемое явление?
Прибор и электроды промыть водопроводной водой, затем дистиллированной и повторить опыт с концентрированным раствором аммиака. Сделать общий вывод из наблюдений.
Опыт 3. Изменение электрической проводимости раствора в результате смещения ионного равновесия
Исследовать отдельно электрическую проводимость 0,02 М раствора серной кислоты и 0,02 М раствора гидроксида бария (см. опыт 1.А). Затем исследовать электрическую проводимость 0,02 М раствора гидроксида бария в присутствии 0,02 М раствора серной кислоты. Для этого в прибор поместить раствор гидроксида бария и добавить 2-3 капли раствора фенолфталеина. Раствор серной кислоты добавлять по каплям из бюретки через воронку, вставленную в крышку прибора. Наблюдать за изменением окраски индикатора и степени накала лампы.
Какова электрическая проводимость раствора в момент исчезновения окраски индикатора (в точке эквивалентности)? Что происходит при добавлении к раствору избытка серной кислоты? Объяснить наблюдаемые явления.
Не нашли, что искали? Воспользуйтесь поиском: