
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Исходный уровень знаний
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ.ТЕРМОХИМИЯ.
Цель занятия.
Изучить и усвоить содержание основных понятий и сущности законов термодинамики, научиться на их основе выполнять различные термодинамические расчеты. Приобрести системные знания об энергетике химических реакций. Научиться применять на практических занятиях теоретический материал по термохимии при решении задач и для объяснения основных биохимических и химических процессов в организме с позиций термодинамики.
Исходный уровень знаний
1. Умение составлять химические уравнения реакций со стехиометрическими коэффициентами.
2. Умение рассчитывать теплоты переходов веществ в различные агрегативные состояния.
3. Знание понятий потенциала ионизации атома и сродства к электрону.
4. Знание процессов растворения веществ и диссоциации электролитов в растворах.
После изучения темы студент должен:
— знать:
– общие понятия термохимии (тепловой эффект реакции, термохимические уравнения, законы термохимии);
– основные типы термохимических циклов и принципы их составления;
— уметь:
– написать термохимическое уравнение реакции;
– рассчитывать тепловой эффект химической реакции, используя справочные данные (теплоты образования и теплоты сгорания веществ);
Учебно-целевые вопросы:
1. Химическая термодинамика как теоретическая основа биоэнергетики.
2. Основные понятия термодинамики:
- интенсивные и экстенсивные параметры
- функция состояния.
- внутренняя энергия.
- работа и теплота
3. Типы термодинамических систем:
- изолированные
- закрытые
- открытые
4. Типы термодинамических процессов
- изотермические
- изобарные
- изохорные
5. Стандартное состояние.
6. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
7. Тепловой эффект химической реакции, знак теплового эффекта. Причины возникновения теплового эффекта реакции. Тепловой эффект химической реакции, протекающей при постоянном объеме или давлении.
8. Закон Гесса
9. Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ.
10. Применения первого начала термодинамики к биосистемам.
11. Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
12. Третье начало термодинамики
13. Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндоргонических процессов, протекающих в организме. Принцип энергетического сопряжения.в живых организмах.
14. Неравновесные процессы. Принцип Пригожина.
15. Биоэнергетика.
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
1. Тепловой эффект химической реакций
2. Тепловой эффект изобарного и изохорного процесса
3. Законы термохимии
4. Теплоты образования и сгорания веществ. Стандартные условия.
5. Термохимические циклы.
6. Знак теплового эффекта эндо- и экзотермических реакций
7. В чем отличие энтальпии от теплоты реакции?
8. Можно ли определить тепловой эффект реакции, которая в реальных условиях не протекает?
9. Как определить теплоту образования сложного органического вещества?
10.Почему теплота растворения соли может быть как больше, так и меньше нуля?
11.Какие соли: безводные или кристаллогидраты – лучше использовать для получения охлаждающих смесей и почему?
12.Изменение энергии Гиббса (при Т и Р const) равно Δ G= ΔН-Т∙Δ S. Условие самопроизвольного протекания процесса при любых условиях:
1) ΔН < 0; Δ S < 0; 2) ΔН > 0; Δ S > 0 3) ΔН < 0; Δ S > 0 4) ΔН > 0; Δ S < 0;
13. Если энтальпия образования SO2 равна-297 кДж/моль, то количество теплоты, выделяемое при сгорании 16 г серы, равно____кДж.
1) 148,5 2) 297 3) 74,25 4) 594
14. Если система находится в состоянии равновесия, то какое из следующих утверждений является верным:
1) ΔG=0 2) K = 1 3) K>1 4) K<1
15. В каком из следующих случаев реакция неосуществима при любых температурах?
1) ΔH>0; ΔS>0 2) ΔH>0; ΔS< 0 3) ΔH<0; ΔS< 0 4) ΔH=0; ΔS= 0
16. В каком из следующих случаев реакция возможна при любых температурах?
1) ΔH<0; ΔS>0 2) ΔH>0; ΔS< 0 3) ΔH<0; ΔS< 0 4) ΔH=0; ΔS= 0
17. Если ΔH<0 и ΔS< 0, то, в каком случае реакция может протекать самопроизвольно?
1) [ΔH]>[T∙ΔS] 2) при любых соотношениях ΔH и T∙ΔS 3) [ΔH]<[T∙ΔS] 4) ΔH=0; ΔS= 0
18. При каких значениях по знаку ΔH и ΔS и системе возможно только экзотермические процессы?
1) ΔH>0; ΔS>0 2) ΔH<0; ΔS> 0 3) ΔH<0; ΔS< 0 4) ΔH=0; ΔS= 0
19. Рассчитать, какое количество энергии выделится при сгорании 1 моль метилового спирта, если теплоты образования СН3ОН, СО2 и Н2О равны соответственно 238,9; 394,9 и 286,6 кДж/моль.
Ответ: 729,2 кДж.
20. Вычислить теплоту образования сахарозы, если теплоты сгорания сахарозы, углерода и водорода равны соответственно 5648,4; 394,9 и 286,6 кДж/моль.
Ответ: – 2243 кДж/моль.
Задания для самоконтроля (включены в коллоквиум и зачетное занятие)
1. Какие процессы называют экзэргоническими?
1) ΔH< 0 2) ΔG < 0 3) ΔH> 0 4) ΔG > 0
2. Какими одновременно действующими факторами определяется направленность химического процесса?
1) энтальпийным и температурным 2) энтальпийным и энтропийным
3) энтропийным и температурным 4) энтропийным и давлением
3. Какой функции состояния соответствует максимальная беспорядочность распределения частиц?
1) энтальпия 2) энтропия 3) энергия Гиббса 4) внутренняя энергия
4. В каком соотношении находится энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
1) S(r) > S(ж) >S(тв) 2) S(тв) > S(ж) > S(r) 3) S(ж) > Sтв) > S(r) 4) S(г) > S(тв) > S(ж)
5. Тепловой эффект реакции, протекающей при постоянном давлении, называется изменением:
1) внутренней энергии 2) энергии Гиббса 3) энтальпии 4) энтропии
6. Первый закон термодинамики отражает связь между:
1) работой, теплотой и внутренней энергией 2) свободной энергией Гиббса, энтальпией системы
3) работой и тепловой энергией 4) работой и внутренней энергией
7. Какое уравнение является математическим выражением 1- го закона термодинамика для закрытых систем?
1) ΔU = 0 2) ΔU = Q – p∙ΔV 3) ΔG = ΔH - T∙ΔS 4) ΔS>0
8. Внутренняя энергия изолированной системы является?
1) постоянной 2) переменной 3) равна нулю 4) уменьшается с ростом температуры
9. Процессы, протекающие при постоянном объеме, называются:
1) изобарическими 2) изотермическими 3) изохорическими 4) изотермо- изобарическими
10.К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещенной в термостат?
1) изолированной 2) открытой 3) закрытой 4) замкнутой
11.К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле?
1) изолированной 2) открытой 3) закрытой 4) замкнутой
12.К какому типу термодинамических систем принадлежит живая клетка?
1) открытой 2) закрытой 3) изолированной 4) замкнутой
13.При каких соотношениях ΔH и ΔS химический процесс находится в состоянии равновесия:
1) ΔH=T∙ΔS 2) ΔH>T∙ΔS 3) ΔH<T∙ΔS 4) ΔH=0; ΔS= 0
14.Какие процессы называют эндэргоническими?
1) ΔH< 0 2) ΔG < 0 3) ΔH> 0 4) ΔG > 0
15. Уравнения реакций, протекание которых возможно в стандартных условиях, имеют вид …
1) 
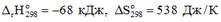
2) C2H5OH + CH3COOH ↔ CH3COOC2H5 +H2O ∆298Н0 = +68 кДж ∆298S0 = -4 Дж/К
3) 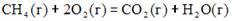

4) 4NО2 (г) + 2Н2О(ж) + О2(г) ↔ 4HNО3(р-p) + Q ∆Н2980 = +803 кДж ∆S2980 = -538 Дж/К
16. Процесс перехода системы из одного состояния в другое при постоянном давлении называется … изобарным
1) изобарным 2) изохорным 3) изотермическим 4) адиабатическим
17.Уравнения реакций, для которых в изобарно-изотермических условиях  имеют вид …
имеют вид …  ,
, 
1) 
2) 
3) 
4) 
18.В основе методов кислотно-основного титрования лежит процесс образования …. слабого электролита
1) слабого электролита 2) малорастворимого соединения 3) комплексных соединений 4) гидратов
19.Если для реакции 
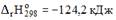 и
и  то температура, при которой возможно ее протекание в прямом и обратном направлении, равна ____
то температура, при которой возможно ее протекание в прямом и обратном направлении, равна ____  (зависимостью термодинамических функций от температуры пренебречь). 392
(зависимостью термодинамических функций от температуры пренебречь). 392
1) 0,665 2) 665 3) 392 4) 272,3
20.Уравнение реакции, в которой для смещения равновесие в сторону продуктов необходимо увеличить температуру, имеет вид … 
1) 
2) 
3) 
4) 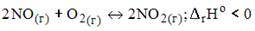
Не нашли, что искали? Воспользуйтесь поиском: