
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химическая кинетика. Химическая кинетика вслед за термодинамикой, является теоретической основой химической технологии, тепловой энергетики
Химическая кинетика вслед за термодинамикой, является теоретической основой химической технологии, тепловой энергетики, металлургии и др.
Принципиальная возможность, направление и глубина протекания химической реакции определяются из анализа начального и конечного состояний по законам термодинамики, а кинетика выясняет реальную возможность и время достижения конечного состояния, в том числе, путем анализа промежуточных состояний.
Например, исходная смесь H2 и O2, несмотря на чрезвычайную выгодность реакции H2 + O2 = H2O, D rG (298) = -229 кДж/моль, может существовать очень долго, однако мгновенно, с взрывом протекает при ее инициировании искрой.
Термодинамический анализ реакции получения HJ позволил рассчитать выход продукта при 718 К, который при эквимолярном соотношении реагентов составил 77,2 % (см. пример 1 в разделе 3.9).

| Рис. 3.2.Изменение концентрации H2 , I2 при синтезе (а) HI и его термической диссоциации (б) во времени при Р =1 атм и температуре 718 К. |
Кинетические измерения (Боденштейн) показали, что равновесное состояние достигается за время ~20 ч. При этом процесс взаимодействия водорода с йодом представляется совокупностью элементарныхреакций с их различным долевым участием, зависящим от температуры и соотношения реагентов.
H2 = H˙ + H˙, J2 = J˙ + J˙, H˙ + J˙ = HJ,
H˙ + J2 = HJ + J˙, J˙ + H2 = HJ + H˙
Кинетическое исследование процессов горения, например H2 в O2, и ряда других позволили Н.Н. Семенову разработать теорию цепных реакций, получить за это звание академика, а впоследствии и Нобелевского лауреата.
Реакция образования воды из H2 и O2 при обычных условиях не происходит из-за высокой энергии активации (см. далее). Инициирование реакции зарождает цепь созданием активных радикальных частиц H·, OH·, O·: 
В результате элементарных реакций, составляющих звено цепи (ЗЦ), наряду с продуктом цепной реакции образуются новые радикалы.

Баланс между ростом числа радикалов и их гибелью на стенках, инертных частицах определяет скорость процесса, которая при малых потерях радикалов носит экспоненциальный, взрывной характер.
Ядерная физика позаимствовала химические представления для цепной реакции деления ядер, условием возникновения которой является наличие размножающихся нейтронов.
Скорость химической реакции по номенклатурным правилам IUPAC определяется как скорость возрастания химической координаты реакции x. Напомним, что для реакции общего вида  (n i < 0 для реагентов), координата реакции имеет вид: x= (ni – ni0)/n i.
(n i < 0 для реагентов), координата реакции имеет вид: x= (ni – ni0)/n i.
Таким образом, скорость произвольной реакции:
 , (3.55)
, (3.55)
где υ i – скорость изменения количества i ‑го компонента, моль/с.
Для гомогенной (объемной) реакции используется отнесенная к единице объема V скорость r, которая связана с объемной концентрацией ci. При учете ni = ci × V
 . (3.56)
. (3.56)
При постоянном объеме (V = const)
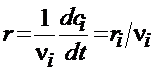 ,
,  , (3.57)
, (3.57)
где компонентная скорость изменения концентрации ri > 0 для продуктов и ri < 0 для исходных веществ.
Для элементарной реакции 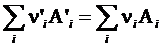 выражение
выражение
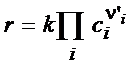 (3.58)
(3.58)
определяет основной закон кинетики или кинетический закон действующих масс (КЗДМ):
Скорость элементарной реакции пропорциональна произведению концентраций реагентов в степенях их стехиометрических коэффициентов.
Коэффициент пропорциональности k называется константой скорости. Коэффициенты n' i в КЗДМ – только целые числа 1, 2, 3.
Впервые КЗДМ сформулирован Гульдбергом и Вааге в 1887 г.
Для двусторонней обратимой реакции
 , (3.59)
, (3.59)
где k +, k − - константы скорости прямой и обратной реакций.
При достижении равновесия (r = 0) 
 (3.60)
(3.60)
отношение констант скоростей прямой и обратной реакций оказывается равным константе равновесия. Это позволяет по k +, рассчитывать k − и наоборот.
На практике n i и n 'i могут отличаться от стехиометрических коэффициентов, что объясняется не элементарностью и скрытой многостадийностью большинства химических реакций. По этой же причине порядок реакции n = Sn 'i не совпадает с величиной, найденной из обработки кинетических кривых.
Объединение формул (3.57) и (3.58) дает дифференциальное уравнение, в данном случае односторонней реакции
 . (3.61)
. (3.61)
В примерах решения или интегрирования этого уравнения для отыскания зависимостей с (t) (т.н. кинетических кривых) индексом “0” отмечены начальные концентрации реагентов.
| (1) | A ® продукты | 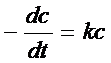 , ,  ,
ln c – ln c 0 = – kt, c = c 0e– kt ,
ln c – ln c 0 = – kt, c = c 0e– kt
| |
| (2) | A + B ® продукты |  , , 
| |
| (3) | A + B + C +... ® продукты (c 0A= c 0B=...,) | 
| |
Для сложных задач химической кинетики из нескольких совместно протекающих реакций созданы и создаются специальные компьютерные программы.
Не нашли, что искали? Воспользуйтесь поиском: