
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Первое начало термодинамики.
Теплоемкость.
· Первое начало термодинамики:
Q = Δ U + A,
где Q - количество тепла, сообщенное системе; А - работа, совершаемая системой; Δ U - приращение внутренней энергии системы.
· Работа, совершаемая газом:
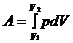
· Теплоемкость системы:
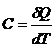
· Уравнение Майера:
Cp – CV = R
где C p, C V - молярные теплоемкости при постоянных давлении и объеме соответственно.
· Внутренняя энергия идеального газа:
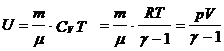
· Молярная теплоемкость идеального газа при политропическом процессе:
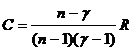
· Внутренняя энергия моля газа Ван - дер - Ваальса:
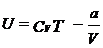
2.1. Газообразный водород, находящийся при нормальных условиях в закрытом сосуде объемом V = 5 л. охладили на Δ T = 55 K. Найти приращение внутренней энергии газа и количество отданного им тепла.
Ответ: 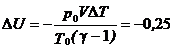 кДж;
кДж; 
2.2. Какое количество тепла надо сообщить азоту при изобарическом нагревании, чтобы газ совершил работу A, равную 2 Дж?
Ответ:  Дж.
Дж.
2.3. Газ, занимающий объем 5 л и находящийся под давлением 2·102 Н/м2 при температуре 17о C, был нагрет и расширялся изобарически. Работа расширения газа при этом оказалась равной 196 Нм. На сколько нагрели газ?
Ответ:  K
K
2.4. На нагревание 40 г кислорода от 16о Cдо40о Cзатрачено 150 кал. При каких условиях нагревался газ? (При постоянном объеме или при постоянном давлении?)
Ответ: при постоянном объеме, т. к.
 Дж;
Дж; 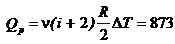 Дж.
Дж.
2.5. Найти молярную массу газа μ, если при нагревании m = 0,5 кг этого газа на Δ T = 10 K изобарически требуется на Δ Q = 1,48 кДжтепла больше, чем при изохорическом нагревании.
Ответ: μ = mR Δ T /Δ Q = 28 г/моль.
2.6. Один моль некоторого идеального газа изобарически нагрели на Δ T = 72 K, сообщив ему количество тепла Q = 1,6 кДж.Найти приращение его внутренней энергии и величину γ = Сp / CV.
Ответ: Δ U = Q - R Δ T = 1 кДж; γ = Q/ (Q - R Δ T) = 1,6.
2.7. Вычислить γдля газовой смеси, состоящей из v 1= 2 моля кислорода и v 2 = 3 моля углекислого газа. Газы считать идеальными.
Ответ: γ = [ v 1 γ 1(γ 2 - 1) + v 2 γ 2(γ 1 - 1)]/[ v 1 (γ 2 - 1 ) + v 2(γ 1 - 1)] = 1,33.
2.8. Вычислить удельные теплоемкости Cp и СV для газовой смеси, состоящей из 7 г азота и 20 г аргона. Газы идеальные.
Ответ: Ср = 0,65 Дж/(г∙К); CV = 0,42 Дж/(г∙К).
2.9. Найти удельные теплоемкости cv и cp некоторого газа, если известно, что масса одного киломоля этого газа равна μ = 30 кг/кмоль и отношение γ = cp/cv = 1,4.
Ответ:
 Дж/кг;
Дж/кг; 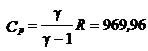 Дж/кг.
Дж/кг.
2.10. При изобарическом расширении кислорода им была совершена работа A = 2·10-6 Дж. Определить изменение внутренней энергии Δ U этого количества газа, количество тепла Q, сообщенного ему в процессе расширения, а также массу газа m, если его температура возросла на 10о. Газ считать идеальным.
Ответ:  ;
;
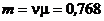 мкг;
мкг;
Δ U = ν C VΔ T = (5/2)ν R Δ T = 4,99∙10-6 Дж;
Q = ν C pΔ T = (7/2)ν R Δ T = 6,99∙10-6 Дж.
2.11. Газ находится в вертикально расположенном цилиндре с площадью дна s = 10 см2. Поршень, закрывающий цилиндр, имеет массу 10 кги может перемещаться в цилиндре без трения. Начальный объем газа 8 л, температура 10о С. Какое количество тепла необходимо затратить для того, чтобы нагреть газ при этих условиях на 25о С, если известно, что теплоемкость CV этой массы газа, измеренная при закрепленном в начальном положении поршне, оказалась равной 25 дж/град? Давление наружного воздуха не учитывать.
Ответ: 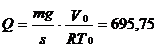 Дж.
Дж.
2.12. В сосуде под поршнем находится m 0 = 10 г азота. 1) Какое количество тепла Q надо затратить, чтобы нагреть азот на Δ t o = 20о С? 2) На сколько при этом поднимается поршень? Масса поршня m = 1 кг, площадь поперечного сечения s = 10 см2. Давление над поршнем равно 1 атм.
Ответ: Q = ν C Δ t o = 20785 Дж; 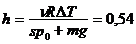 м.
м.
2.13. 2 л азота находятся под давлением 105 н/м2. Какое количество тепла надо сообщить азоту, чтобы при p = const объем увеличить вдвое?
Ответ: Q =pCpV/R = 700 Дж.
2.14. 2 л азота находятся под давлением 105 н/м2. Какое количество тепла надо сообщить азоту, чтобы при V = const давление увеличить вдвое?
Ответ: Q = CVVp/R = 500 Дж.
2.15. Найти молярную теплоемкость идеального газа при политропическом процессе pV n = соnst, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Ответ: С = Р (п -γ) / (n - 1)(γ - 1); С < 0 при 1 < n < γ.
2.16. Имеется идеальный газ, молярная теплоемкость СV которого известна. Найти молярную теплоемкость этого газа как функцию его объема V, если газ совершает процесс по закону:
а) Т = T 0 e αV; б) р = p 0eαV, где T 0, p 0, α-постоянные.
Ответ: а) С = CV + R/ α V; б) С = СV + R /(1 + α V).
2.17. Один моль идеального газа, теплоемкость которого при постоянном давлении Сp, совершает процесс по закону p = р 0 + α/ V, где р 0, α - постоянные. Найти:
а) теплоемкость газа как функцию его объема V;
б) сообщенное газу тепло при его расширении от V 1до V 2.
Ответ: a) C = γ R /(γ - 1) + α R / p 0 V;
б) Q = p 0(V 2 – V 1) C P/ R + αln(V 2/ V 1).
2.18. Найти уравнение процесса (в переменных Т, V). при котором молярная теплоемкость идеального газа изменяется по закону:
а) С = СV + αТ;
б) С = СV + βТ;
в) С = СV + ap.
Здесь α, β, а - постоянные.
Ответ: a) Ve- α T/R = const; б) VeR/βV = const; в) V - аТ = const.
2.19. Один моль кислорода, находившегося при температуре T 0 = 290 K, адиабатически сжали так, что его давление возросло в η = 10 раз. Найти:
а) температуру газа после сжатия;
б) работу, которая была совершена над газом.
Ответ: а) Т = T 0 η (γ-1)/γ = 560 K;
б) A' = RT 0(η 1-1/γ - 1) / (γ - 1) = 5.6 кДж.
2.20. Некоторую массу азота сжали в η = 5 раз (по объему) один раз адиабатически, другой раз изотермически. Начальное состояние газа в обоих случаях одинаково. Найти отношение соответствующих работ, затраченных на сжатие.
Ответ: При адиабатическом сжатии работа больше в
n = (ηγ-1 – 1)/(γ – 1)lnη = 1,4 раза.
2.21. Объем моля идеального газа с показателем адиабаты γ изменяют по закону V = а/Т. где а - постоянная. Найти количество тепла, полученное газом в этом процессе, если его температура испытала приращение Δ T.
Ответ: Δ Q = R Δ T (2 - γ)/(γ - 1).
2.22. Найти работу, совершаемую одним молем ван-дер-ваальсовского газа при изотермическом расширении его объема от V 1 до V 2 при температуре Т.
Ответ: А = RТ ∙ln[(V 2 - b)/(V 1 – b)] + a/V 2 - a/V 1.
2.23. Один моль кислорода расширили от объема V 1 = 1 л: до V 2 = 5 л при постоянной температуре Т = 280 K. Вычислить количество поглощенного газом тепла. (Газ считать ван-дер-ваальсовским.)
Ответ: Q = RТ ∙ln[(V 2 - b)/(V 1 – b)] = 3.8 кДж.
2.24. Найти для ван-дер-ваальсовского газа уравнение адиабаты в переменных (T, V), если его теплоемкость при постоянном объеме равна CV.
Ответ: T (V - b) R / Cv = const.
2.25. Определить для ван-дер-ваальсовского газа разность молярных теплоемкостей Cp – СV.
Ответ: C p – СV = R /[l - 2 a (V - b)2/ RTV 3].
2.26. Показать, что между адиабатической и изотермической сжимаемостями (χa д = -(1/ V)∙(дV / дp), χT = -(1/ V)∙(дV / дp)T) существует соотношение: χ aд = χ T /γ, где γ = Cp / CV.
2.27. Показать, что если уравнение состояния имеет вид p = p (T, V), то справедливо соотношение: р α р = K α V, где
α р = (др / дТ) V / р - тепловой коэффициент давления при постоянном объеме,
α V = (дV / дT) p / V - коэффициент теплового расширения при постоянном давлении,
K = -V (др/дV)Т - изотермический модуль упругости.
2.28. В цилиндре, закрытом с обоих концов и наполненном воздухом, находится поршень, разделяющий пространство в цилиндре на две равные части. Давление воздуха по обе стороны поршня равно p 0= 105 Пa. Поршень начинает совершать малые колебания, причем процесс в газе считаем адиабатическим. Масса поршня m = 1,5 кг, расстояние от стенки до поршня l = 20 см. площадь поршня S = 100 см2. Трением пренебрегаем. Определить период колебаний поршня.
Ответ:  0,05 с.
0,05 с.
2.29 Моль идеального газа находится в неограниченном вертикальном цилиндре, помещенном в однородное поле тяжести. Найти теплоемкость газа.
Ответ: С = СV + R = Ср.
2.30. Рассматривая воздух как идеальный газ, показать, что при нагревании воздуха, находящегося в комнате, его внутренняя энергия не меняется, если только внешнее давление остается постоянным.
Ответ: результат следует из формулы U = СVPV/R.
2.31. С какой высоты упал медный шар, если при столкновении с почвой его температура повысилась с 20оС до 23оС?Считать, что выделившееся в результате столкновения количество теплоты распределилось между медным шаром и почвой в соотношении 1: 2. Сопротивлением воздуха пренебречь. См = 390 Дж/(кг∙К).
Ответ: h = 3 См Δ T / g = 358 м.
2.32. Внутренняя энергия теплового излучения в замкнутой полости с объемом V определяется выражением U = Vu,где плотность энергии и = аТ 4(постоянная а > 0), а давление излучения определяется уравнением состояния p = u /3. Найти уравнение адиабатического процесса.
Ответ: PV 4/3 = const.
Не нашли, что искали? Воспользуйтесь поиском: