
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретические сведения. Изолированные газы в виде разряженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий разной интенсивности
Изолированные газы в виде разряженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий разной интенсивности, соответствующих различным длинам волн. В соответствии с этим спектр испускания атомов называется линейчатым.
Швейцарский ученый И.Бальмер в результате длительного изучения линейчатого спектра атомарного водорода установил закономерности в расположении линий в видимой области спектра. В настоящее время в спектре водорода наблюдается 6 серий, которые описываются формулой
 (11.1)
(11.1)
где λ – длина волны соответствующей линии, R=1,097.107 м-1 – постоянная Ридберга, m и n – целые числа, причем n принимает значения, начиная с m+1.
m определяет спектральную серию: m=1 – серия Лаймана, m=2 – серия Бальмера, m=3 – серия Пашена, m=4 – серия Брекетта, m=5 – серия Пфунда, m=6 – серия Хемфри.
Изучение атомных спектров послужило ключом к познанию строения атома. Задача объяснения закономерности в линейчатых спектрах излучения привела к проблеме строения атома. Попытки построить модель атома, которая смогла бы объяснить возникновение спектров испускания, были предприняты Томсоном (1903 г.), Резерфордом (1913 г.) и потерпели неудачу.
Первая попытка построения неклассической теории атома была предпринята Н.Бором в 1913 г. В основе этой теории лежала идея связать в единое целое эмпирические закономерности линейчатых спектров (формулу Бальмера), ядерную модель Резерфорда и квантовый характер излучения света (теория Планка). В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Однако Бору пришлось дополнить классическое описание состояния электрона в атоме некоторыми ограничениями. Эти ограничения были сформулированы в виде постулатов.
Первый постулат Бора (постулат стационарных состояний) заключается в следующем: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, энергии которых составляют дискретный ряд: W1 ,W2,W3,...В стационарном состоянии атом не излучает.
Второй постулат Бора (правила квантования орбит): в стационарном состоянии атома электрон движется только по таким орбитам, для которых момент импульса электрона удовлетворяет условию:
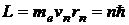 , (11.2)
, (11.2)
где ħ – постоянная Планка, равная 1,054.10-34 Дж.с; n=1,2,3,…; me – масса электрона; rn – радиус соответствующей орбиты.; vn – скорость электрона.
Третий постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
Излучение происходит при переходе из состояния с большей энергией в состояние с меньшей энергией, т.е. при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру:
 (11.3)
(11.3)
где  – энергия электрона на соответствующей орбите;
– энергия электрона на соответствующей орбите;  – квант энергии;
– квант энергии; 
 – циклическая частота излучения.
– циклическая частота излучения.
Теория Бора дала возможность построить модель атома водорода и водородоподобных ионов  . Согласно этой теории атом состоит из ядра и электрона, движущегося по круговым стационарным орбитам. Электрон удерживается на круговой орбите кулоновской силой. Определим полную энергию электрона в водородоподобном атоме. Полная энергия электрона на орбите складывается из кинетической энергии электрона
. Согласно этой теории атом состоит из ядра и электрона, движущегося по круговым стационарным орбитам. Электрон удерживается на круговой орбите кулоновской силой. Определим полную энергию электрона в водородоподобном атоме. Полная энергия электрона на орбите складывается из кинетической энергии электрона  и потенциальной энергии взаимодействия электрона с ядром
и потенциальной энергии взаимодействия электрона с ядром  , где:
, где:
 – масса электрона;
– масса электрона;
 – линейная скорость электрона на орбите;
– линейная скорость электрона на орбите;
 – зарядовое число ядра атома;
– зарядовое число ядра атома;
 – заряд электрона;
– заряд электрона;
 – электрическая постоянная;
– электрическая постоянная;
 – радиус орбиты.
– радиус орбиты.
 . (11.4)
. (11.4)
Кулоновская сила сообщает электрону центростремительное ускорение, т.е.
 (11.5)
(11.5)
Из (11.5) следует, что
 , (11.6)
, (11.6)
т.е. потенциальная энергия равна удвоенному значению его кинетической энергии:
 . (11.7)
. (11.7)
Подставив (11.5) в (11.4), получим:
 . (11.8)
. (11.8)
Для определения радиуса орбиты  воспользуемся вторым постулатом Бора
воспользуемся вторым постулатом Бора  и равенством (11.5). Решив систему двух уравнений относительно
и равенством (11.5). Решив систему двух уравнений относительно  , получим:
, получим:
 . (11.9)
. (11.9)
Таким образом rn~n2, т.е. с ростом номера орбиты радиус ее растет. Для водорода (z=1) при n =1:  радиус первой Боровской орбиты.
радиус первой Боровской орбиты.
Подставив (11.9) в выражение (11.8), получим:
 (11.10)
(11.10)
Таким образом, из выражения (11.10) следует:
1. Полная энергия электрона в атоме отрицательна.
2. Энергия электрона в атоме принимает дискретный ряд значений, которые можно представить на рисунке 11.1
 |
Рисунок 11.1. Энергетический спектр атома
При n =1 энергия минимальна, при n →∞ энергия электрона максимальна, и он покидает атом. Атом при этом ионизируется.
Воспользуемся третьим постулатом Бора и формулой энергии электрона (11.10), определим длину волны излучения при переходе электрона из одного энергетического состояния в другое.
Длина волны связана с циклической частотой соотношением  , где с – скорость света в вакууме. Поскольку
, где с – скорость света в вакууме. Поскольку  то
то  , где
, где  – энергия на n уровне;
– энергия на n уровне;
 – энергия на m уровне. Причем n>m.
– энергия на m уровне. Причем n>m.
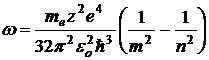 . (11.11)
. (11.11)
Для длины волны формулу (11.11) можно записать в виде:
 . (11.12)
. (11.12)
Обозначив  получим обобщенную формулу Бальмера:
получим обобщенную формулу Бальмера:
 (11.13)
(11.13)
где R – постоянная Ридберга.
Теория Бора смогла объяснить факт испускания света атомом: при переходе электрона из состояния с большей энергией Wn в состояние с меньшей энергией Wm атом излучает квант энергии  .(На рисунке 11.2 – переходы 2 и 3).
.(На рисунке 11.2 – переходы 2 и 3).
При поглощении порции энергии ΔW электрон переходит из основного состояния (n =1) в возбужденное (переход 1 на рисунке 11.2). В этом состоянии атом пребывает незначительный промежуток времени Δt~10-8 с, а затем переходит в основное состояние, причем этот переход может осуществляться ступенчато.
 |
Рисунок 11.2. Возможные переходы электронов в атоме
Описание установки
Для исследования спектра испускания водорода применяется гониометр типа Федорова. Этот гониометр представляет собой двухтрубный спектроскоп, принципиальная схема которого приведена на рисунке 11.3.
 |
Рисунок 11.3. Принципиальная схема гониометра:
S – источник света; 1 – коллиматор; 2 – призма трехгранная; 3 – зрительная труба.
Коллиматор – это труба со щелью на одном конце, ширину которой можно менять регулировочным винтом. На другом конце коллиматора расположена ахроматическая собирающая линза. Коллиматор создает параллельный пучок лучей, падающих на призму. Зрительная труба имеет объектив и окуляр, при помощи которого рассматривается спектр исследуемого вещества. Призма обладает относительно большой дисперсией, поэтому весь спектр одновременно в поле зрения не виден. Для определения длин волн, излучаемых исследуемым веществом, необходимо знать дисперсионную кривую прибора, т.е. графическую зависимость углового расположения спектральных линий в поле зрения окуляра от длины волны. Строится дисперсионная кривая при помощи линейчатых спектров элементов, длины волн которых известны (например, ртуть, гелий). По дисперсионной кривой можно определить длины волн всех спектральных линий водорода.
11.3 Приборы и материалы: монохроматор, ртутная лампа, водородная трубка.
Не нашли, что искали? Воспользуйтесь поиском: