
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Основное уравнение молекулярно-кинетической теории
Как было установлено, основной характеристикой внутреннего состояния любых систем (твердых, жидких или газообразных), состоящих из достаточно большого числа частиц-молекул, является температура. Такие системы, основной характеристикой внутреннего состояния которых является температура, называются термодинамическими. С другой стороны, простейшей (не равной нулю) характеристикой молекулярного движения является средний квадрат скорости  .
.
Более привычной величиной, содержащей эту характеристику, является средняя кинетическая энергия молекулы или просто кинетическая энергия.
 (1.34)
(1.34)
Очевидно, что m 0 — масса одной молекулы.
Разумно предположить, что температура и средняя энергия молекулярного движения — внутренняя энергия, приходящаяся на одну молекулу, должны быть связаны между собой.
Эта связь 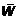 и Т имеет самый простой — простейший вид. Оказывается, что средняя энергия хаотического движения молекул (бывает и направленное — «ветер») газа прямо пропорциональна температуре. Весь дальнейший длинный вывод нужен для определения коэффициента пропорциональности. Попутно, однако, выявляется много нового. Итак, в путь!
и Т имеет самый простой — простейший вид. Оказывается, что средняя энергия хаотического движения молекул (бывает и направленное — «ветер») газа прямо пропорциональна температуре. Весь дальнейший длинный вывод нужен для определения коэффициента пропорциональности. Попутно, однако, выявляется много нового. Итак, в путь!
Чтобы установить эту связь, вспомним, что температура связана с другими характеристиками газа уравнением состояния или
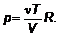 (1.35)
(1.35)
Параметры: р — давление, V — объем, ν — количество вещества (в молях), наряду с температурой, являются характеристиками газа в целом.
Такие характеристики называются макроскопическими — «большими». С другой стороны, такие величины, как масса одной молекулы т 0; скорость 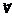 (Vx; Vу; Vz), следовательно, квадрат скорости V 2, являются характеристикой одной молекулы, и их, естественно, называют микроскопическими. Выпишем:
(Vx; Vу; Vz), следовательно, квадрат скорости V 2, являются характеристикой одной молекулы, и их, естественно, называют микроскопическими. Выпишем:
макроскопические характеристики 
| микроскопические характеристики

| |
| Давление, объем, температура, масса газа, плотность и количество вещества, равное общему числу молекул, отнесенному к числу Авогадро (или равное массе газа, отнесенной к молярной массе). | Масса молекулы, три проекции скорости на оси координат и образованный из них квадрат скорости
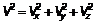 . .
|
Оказывается, что легче всего связать с микроскопическими характеристиками давление. С одной стороны, давление р = F / S, т. е. сила, действующая со стороны газа на единицу площади S поверхности стенок сосуда, окружающего газ. С другой стороны, очевидно, что сила действия газа на стенку возникает из-за ударов молекул (рис. 1.14).

Рис. 1.14. Удар молекулы о стенку, перпендикулярно направленную ее движению
Найти: р —? Дано: m 0; V 2; N; V.
Решение.
 (1.36)
(1.36)
где F — сила действия всех N молекул.
Силу действия всех молекул F можно выразить через силу действия на стенку одной молекулы f. Запишем:
 (1.37)
(1.37)
где Z — число ударов молекул о стенку площадью S за время t. Знак усреднения в этой формуле необходим. Прибор, измеряющий давления, сам (будучи макроскопическим — «большим») производит усреднение. Если бы была возможность поставить прибор, который регистрировал бы «каждый» удар отдельно, то на графике зависимости давления от времени появилась бы «мелкозубая пила» (рис. 1.15).
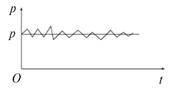
Рис. 1.15. Превращение микроскопической характеристики в макроскопическую
В действительности прибор не успевает столь быстро реагировать. С другой стороны, характеристики «зубчиков» никого не интересуют. Поэтому давление — среднее значение. Перефразируя Григория Сковороду, скажем: «Сложное — не нужно, а ненужное — сложно». Впрочем, не все с этим согласны.
Перейдем к вычислению числа Z ударов молекул о стенку за время t. Соударение со стенкой испытают все молекулы, которые за время t успеют долететь до стенки. Долететь же они успеют с расстояния Vxt, т. к. движение можно считать равномерным. (Сил взаимодействия во время движения нет — это одно из приближений идеального газа, см. рис. 1.12.) С большего расстояния молекулы не успевают долететь до стенки. Объем, из которого молекулы долетают до стенки (рис. 1.16), равен VxtS (произведение длины Vxt на площадь S). В этом объеме находятся nVxtS молекул; произведение концентрацииn = N / V молекул на только что подсчитанный объем, из которого молекулы долетают до стенки.

Рис. 1.16. К вычислению числа молекул, сталкивающихся со стенкой.
Заштрихован объем, из которого молекулы долетают до стенки
Однако о стенку ударит только половина этого числа. Другая половина имеет Vx компоненту скорости, направленную от стенки, и летит в противоположном направлении.
Итак,
 (1.38)
(1.38)
Теперь вычислим силу действия одной молекулы, которая, имея скорость Vx, ударяет о стенки. Прежде всего, отметим, что для анализа движения такой молекулы будет применяться механика Ньютона. Для столь малого объекта, как молекула, применимость механики требует оговорки, ведь установлена механика Ньютона (классическая механика) на основе рассмотрения движения макроскопических тел. Считается, что в идеальном газе, где молекулы рассматриваются, как малые шарики, такое приближение применимо. Кроме того, принимают, что в идеальном газе взаимодействие на малых расстояниях считается бесконечно сильным, упругим (см. п. 2.6).
Удобно вообще не анализировать, «что там происходит при ударе молекулы о стенку», а учесть изменение импульса:
 (1.39)
(1.39)
как разность импульса в конечном состоянии m 0 Vх (после удара) и импульса в начальном состоянии (до удара) т 0 V 0 x. «Упругость» проявляется в том, что начальная и конечная скорости равны по величине, но противоположны по направлению: V 0 x = – Vx. Тогда сила удара молекулы о стенку будет
 (1.40)
(1.40)
Вычисляем силу действия всех молекул газа на стенку:
 (1.41)
(1.41)
Видим, что время t сократилось, значит, сила действия молекул газа на стенку постоянная. Все величины в формуле силы постоянные, кроме скорости Vx. Как и следовало ожидать, в макроскопическую характеристику, силу, вошел средний квадрат скорости движения молекулы. Как уже указывалось (см. рис. 1.13), средний квадрат скоростей молекул в любой момент времени равен среднему квадрату скорости одной молекулы за достаточно длительное время. Это утверждение, как уже указывалось, называется эргодической гипотезой. Принимаем эту гипотезу. Она верна!
До сих пор рассматривались молекулы со скоростями, параллельными оси x. Реально, конечно, молекулы могут иметь произвольно направленные скорости (рис. 1.17).

Рис. 1.17. Скорость в пространстве
Введение осей — дело рук человеческих. Молекулы «не знают», как мы провели и обозначили оси. Можно было, например, направить ось x, как y, a y — как x. Поэтому хаотичность движения проявляется в том, что в среднем:
 (1.42)
(1.42)
Нужная нам проекция:
 (1.43)
(1.43)
Тогда давление на стенку будет
 (1.44)
(1.44)
Обратим внимание на правильность чтения. Например, 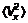 читается «средний квадрат проекции скорости на ось х». Прочесть «квадрат средней скорости» — неверно! Квадрат средней проекции скорости
читается «средний квадрат проекции скорости на ось х». Прочесть «квадрат средней скорости» — неверно! Квадрат средней проекции скорости  равен нулю.
равен нулю.
Так как давление зависит от скорости (пусть от среднего квадрата скорости), то сила давления pS — не консервативна, т. е. работа этой силы зависит от способа (от пути), которым совершается эта работа.
Итак, давление прямо пропорционально среднему квадрату скорости.
Теперь можно записать и результат — основное уравнение молекулярно-кинетической теории газа:
 (1.45)
(1.45)
где, вспомним, 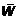 — средняя кинетическая энергия молекулы идеального газа,
— средняя кинетическая энергия молекулы идеального газа,
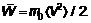 (1.46)
(1.46)
Главный результат можно сформулировать так: давление пропорционально средней энергии молекул газа и концентрации этого газа.
 (1.47)
(1.47)
Учет реальности газа, такой как учет собственного объема молекул или парных взаимодействий, не изменит того, что произведение pV (может быть несколько измененное) пропорционально энергии молекул газа.
Не нашли, что искали? Воспользуйтесь поиском: