
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Д.И. МЕНДЕЛЕЕВА
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение.
Высшую степень окисления элемента определяет номер группы периодической системы Д.М. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (n s 2n p 6).
Данные элементы находятся соответственно в VA, VIA, VIIA – группах и имеют структуру внешнего энергетического уровня s 2 p 3, s 2 p 4 и s 2 p 5.
| Элемент | Степень окисления | Соединения | |
| высшая | низшая | ||
| As | +5 | -3 | H3AsO4, H3As |
| Se | +6 | -2 | SeO3, Na2Se |
| Br | +7 | -1 | KBrO4, KBr |
Пример 2. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства?
Решение.
Электронные формулы данных элементов
25Mn 1 s 22 s 22 p 63 s 23 p 63 d 54 s 2;
35Br 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 5.
Марганец – d -элемент VIIB-группы, а бром – p -элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p - и d -элементы, является преобладание металлических свойств у d -элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными (амфолитами)?
Решение.
Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э -- О и О -- Н может протекать по двум типам:
ЭОН 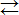 Э+ + ОН- (I) или ЭОН
Э+ + ОН- (I) или ЭОН 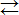 ЭО- + Н+ (II).
ЭО- + Н+ (II).
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если EO-H < EЭ-О (высокая степень окисления), а по основному типу, если EO-H > EЭ-О (низкая степень окисления). Если прочности связей О – Н и Э – О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
Эn+ + nOH- 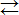 Э(OH)n = HnЭOn
Э(OH)n = HnЭOn 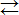 nH+ + ЭОnn–
nH+ + ЭОnn–
как основание как кислота
Э – элемент, n- его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислый характер:
Ga(OH)3 + 3HCl = GaCl3 + 3H2O;
Ga(OH)3 + 3NaOH = Na3GaO3 + 3H2O.
Не нашли, что искали? Воспользуйтесь поиском: