
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
(ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ)
При решении задач этого раздела используйте табл. 4 приложения.
Наука о взаимных превращениях различных видов энергии называется термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называется термохимией. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты, - эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы – закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии ΔU и на совершение работы А:
Q = ΔU + А.
Внутренняя энергия системы U – это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия – это полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение Uвеществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс ΔU = U2 - U1, где ΔU- изменение внутренней энергии системы при переходе от начального состояния U1 в конечное U2. Если U2> U1, тоΔU > 0. Если U2< U1, тоΔU < 0.
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А – это работа против внешнего давления, т.е. в первом приближении А = рΔV, где ΔV- изменение объема системы (V2 – V1).Так как большинство химических реакций проводят при постоянном давлении, то для изобарно-изотермического процесса (P = const, T = const) теплота Qрбудет равна Qр= ΔU + рΔV;
Qр= (U2 - U1) + р(V2 – V1); Qр= (U2 + pV2) – (U1 + pV1).
Сумму U + pV обозначим через Н, тогда Qр= Н2 – Н1 = ΔН.
Величину Н называют энтальпией. Таким образом, теплота при Р = const приобретает свойства функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе Qрравна изменению энтальпии системы ΔН, если единственным видом работы является работа расширения, Qр = ΔН.
Энтальпия Н, как и внутренняя энергия U, является функцией состояния: ее изменение ΔН определяется только начальным и конечным состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе Qv(V = const, T = const), при котором ΔV = 0, равна изменению внутренней энергии системы, Qv = ΔU.
Теплоты химических процессов, протекающих при P,Т = const и V, Т = const, называются тепловыми эффектами.
При экзотермических реакциях энтальпия системы уменьшаетсяΔН < 0 (H2 < H1), а при эндотермических – увеличивается ΔН > 0 (H2 > H1). В дальнейшем тепловой эффект всюду выражается через ΔН.
В основе термохимических расчетов лежит закон Гесса: «Тепловой эффект реакции зависит только от природы и физических состояний исходных веществ и конечных продуктов, но не зависит от пути перехода».
В термохимических расчетах используют следствие из закона Гесса: «Тепловой эффект реакции ΔНх.р.равен сумме теплот образования ΔНобрпродуктов реакции за вычетом суммы теплот образования исходных веществ ΔНисх, с учетом коэффициентов перед формулами этих веществ в уравнении реакции».
∆H = ∑ni∆Hпрод – ∑nj∆Hисх.
Пример 1. При взаимодействии кристаллического хлорида фосфора (V) с парами воды образуются жидкая хлорокись фосфора РОСl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение.
Уравнения реакций, в которых за символами химических соединений указываются их агрегатные состояния или кристаллические модификации, а также числовые значения тепловых эффектов, называются термохимическими. В термохимических уравнениях, если специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qр, равные изменениям энтальпии реакции ΔН.
Значение ΔНприводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращения обозначения агрегатного состояния веществ: г – газообразное, ж – жидкое, к – кристаллическое. Эти символы опускаются, если агрегатное состояние вещества очевидно.
Если теплота в результате реакции выделяется, то ΔН<0. Учитывая изложенное, составляем термохимическое уравнение данной в примере реакции:
РСl5(к) + Н2О = РОСl3(ж) + 2HСl(г); ΔНх.р. = - 111,4 кДж.
Пример 2. Реакция горения этана выражается термохимическим уравнением
С2Н6(г) + 3½О2(г) = 2СО2(г) + 3Н2О(ж); ΔНх.р. = - 1559,87 кДж.
Вычислить теплоту образования этана, если известны теплоты образования СО2(г)и Н2О(ж)(табл. 4).
Решение.
Теплотой образования (энтальпией) соединения называют тепловой эффект реакции образования одного моля этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е. 25оС (298 К) и 1 атм и обозначают через ΔН 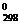 .
.
Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С(граф) + 3Н2(г) = С2Н6(г); ΔН =?
исходя из следующих данных:
а) С2Н6(г) + 3,5О2(г) = 2СО2(г) + 3Н2О(ж); ΔН = - 1559,87 кДж;
б) С(граф) + О2(г) = СО2(г); ΔН = - 393,51 кДж;
в) Н2(г) + 0,5О2(г) = Н2О(ж); ΔН = - 285,84 кДж.
На основании закона Гесса термохимическими уравнениями можно оперировать так же, как и алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а за тем сумму этих уравнений вычесть из уравнения (а):
С2Н6 +3,5О2 –2С – 2О2–3Н2 –1,5О2= 2СО2 + 3Н2О –2СО2 – 3Н2О;
С2Н6 = 2С + 3Н2;
ΔН = - 1559,87 + 787,02 + 857,52;
ΔН = +84,67 кДж.
Так как теплота образования равна теплоте разложения с обратным знаком, то ΔН 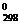 С2Н6(г)=- 84,67 кДж.К этому же результату придем, если для решения задачи применим следствие из закона Гесса ΔНх.р. = 2ΔН
С2Н6(г)=- 84,67 кДж.К этому же результату придем, если для решения задачи применим следствие из закона Гесса ΔНх.р. = 2ΔН 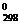 СО2 + 3ΔН
СО2 + 3ΔН 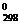 Н2О – ΔН
Н2О – ΔН 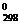 С2Н6 - 3,5ΔН
С2Н6 - 3,5ΔН 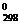 О2.
О2.
Учитывая, что теплоты образования простых веществ условно приняты равными нулю,
ΔН 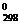 С2Н6 = 2ΔН
С2Н6 = 2ΔН 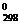 СО2 + 3ΔН
СО2 + 3ΔН 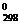 Н2О – ΔНх.р.;
Н2О – ΔНх.р.;
ΔН 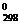 С2Н6 = 2(- 393,51) + 3(- 285,84) = 1559,87 = - 84,67 кДж;
С2Н6 = 2(- 393,51) + 3(- 285,84) = 1559,87 = - 84,67 кДж;
ΔН 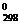 С2Н6 = - 84,67 кДж.
С2Н6 = - 84,67 кДж.
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); ΔН =?
Вычислить тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж)равна + 42,36 кДж и известны теплоты образования: С2Н5ОН(г), СО2(г)и Н2О(ж)(табл. 4).
Решение.
Для определения ΔНреакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных задачи: С2Н5ОН(ж) = С2Н5ОН(г); ΔН = + 42,36 кДж.
+ 42,36 = - 235,31 – ΔНС2Н5ОН(ж).
ΔНС2Н5ОН(ж) = - 235,31 – 42,36 = - 277,67 кДж.
Вычисляем ΔН реакции, применяя следствие из закона Гесса:ΔН = 2(- 393,51) + 3(- 285,84) – (- 277,67) = - 1366,87 кДж.
Пример 4. Растворение 1 моля безводной соды Na2CO3в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидратаNa2CO3∙10H2Oпоглощается 66,94 кДж теплоты. Вычислите теплоту гидратации Na2CO3(теплоту образования кристаллогидрата).
Решение.
Составляем термохимические уравнения соответствующих реакций:
а) Na2CO3 + 10H2O + aq = Na2CO3·aq; ΔН = - 25,10 кДж;
б) Na2CO3∙10H2O + aq = Na2CO3·aq; ΔН = + 66,94 кДж.
Вычитая уравнение (б) из уравнения (а), получаем ответ:
Na2CO3 + 10H2O = Na2CO3∙10H2O; ΔН = - 92,04 кДж, т.е. при образовании Na2CO3·10H2Oвыделяется 92,04 кДж теплоты.
Не нашли, что искали? Воспользуйтесь поиском: